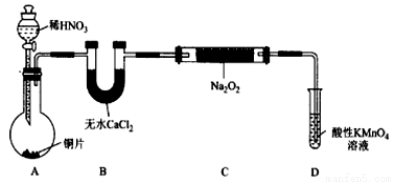
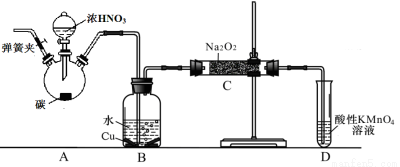
题目内容
能正确表示下列反应的离子方程式的是( )
A.Fe3O4溶于足量稀HNO3中:Fe3O4+8H+= Fe2++2Fe3++4H2O
B.NH4HCO3溶液与足量NaOH溶液混合:HCO3-+Na++ OH-=CO32-+ H2O
C.将过量的SO2通入NaClO溶液中:SO2+ClO-+ H2O= HClO+HSO3-
D.将0.2mol•L-1KAl(SO4)2溶液与0.3 mol•L-1Ba(OH)2溶液等体积混合:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3 ↓+ 3BaSO4↓
练习册系列答案
相关题目
根据下列 实验操作和现象所得出的结论错误的是
实验操作和现象所得出的结论错误的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向FeBr2溶液中通入少量Cl2 | 溶液由浅绿 色变为黄色 | 氧化性:Cl2>Fe3+ |
B | 向Na2SO3溶液中滴加盐酸 | 有气体产生 | 非金属性:Cl>S |
C | 向PH=3的HA和HB溶液中分别加水稀释至100倍 | pH(HA)>pH(HB) | 酸性:HA>HB |
D | 向重晶石中加入饱和碳酸钠溶液 | 重晶石逐渐溶解 | 溶度积:Ksp(BaCO3)<Ksp(BaSO4) |


 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( ) s)═3AlCl(g)+3CO(g) △H=akJ·mol-1
s)═3AlCl(g)+3CO(g) △H=akJ·mol-1 N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H=Q kJ·mol-1。在T1℃时,反应进行到不同时间测得各物质的浓度如下: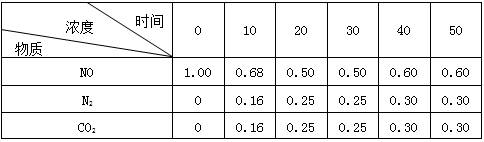
 发生改变
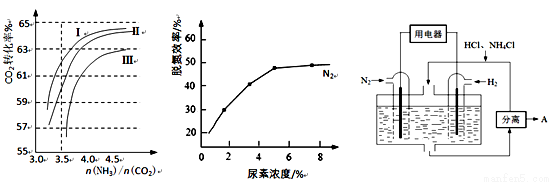
发生改变 CO(NH2)2(l)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。
CO(NH2)2(l)+H2O(g) 在合成塔中进行。下图1中Ⅰ、Ⅱ、Ⅲ三条曲线为合成塔中按不同氨碳比 [n(NH3)/n(CO2)]和水碳比[n(H2O)/n(CO2)]投料时二氧化碳转化率的情况。