题目内容
【题目】工业上常采取以下方法除去H2S和SO2以减少有害气体的排放。完成下列填空:
I.H2S的除去
用Fe2(SO4)3溶液吸收H2S生成FeSO4。FeSO4被O2氧化使Fe2(SO4)3再生,其原理为:□FeSO4+□O2+□H2SO4![]() □Fe2(SO4)3+□ 。
□Fe2(SO4)3+□ 。
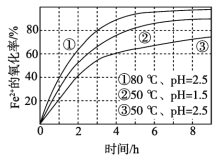
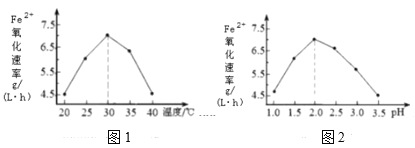
(1)硫杆菌存在时,FeSO4被氧化的速率是无菌时的5×105倍。由图1和图2判断,使用硫杆菌的最佳条件为__;若反应温度过高,反应速率下降,其原因是__。
(2)补全、配平Fe2(SO4)3再生的化学方程式,并标出电子转移的数目和方向。______。
(3)在一定条件下,也可以用H2O2氧化H2S,其氧化产物随参加反应的n(H2O2)/n(H2S)变化而不同,当n(H2O2)/n(H2S)=4时,氧化产物的化学式为__。
II.SO2的除去
用NaOH溶液吸收SO2,并用CaO使NaOH再生:NaOH溶液![]() Na2SO3溶液
Na2SO3溶液
(4)写出过程①的离子方程式:___。
(5)CaO在水中存在如下转化:CaO(s)+H2O(l)=Ca(OH)2(s)![]() Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
Ca2+(aq)+2OH-(aq)。从平衡移动的角度,简述过程②NaOH再生的原理____。
(6)也可用氨水除去SO2。某废气含0.2%SO2和10%SO2(体积含量,其余为N2),一定条件下,该废气以5m3/h的速率通过催化剂与速率为20L/h的NH3混合,再喷水,得到(NH4)2SO4晶体(气体体积均已折算为标准状况)。通过计算说明NH3速率控制在20L/h的原因。________。
【答案】30℃、pH=2 催化剂活性下降或催化剂在30℃时活性最大 ![]() H2SO4 2OH-+SO2=SO32-+H2O SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成 废气每小时排放SO2为:1000L/m3×5m3/h×0.2%=10L/h,氨气与SO2气体的速度比值符合2:1,两者完全转化为(NH4)2SO4
H2SO4 2OH-+SO2=SO32-+H2O SO32-与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成 废气每小时排放SO2为:1000L/m3×5m3/h×0.2%=10L/h,氨气与SO2气体的速度比值符合2:1,两者完全转化为(NH4)2SO4
【解析】
(1)用Fe2(SO4)3吸收H2S,硫化氢具有还原性,硫酸铁具有氧化性,二者发生氧化还原反应生成单质硫,反应的离子方程式为:2Fe3++H2S═2Fe2++S↓+2H+,从图象中分析可知,使用硫杆菌的最佳条件是亚铁离子氧化速率最大时,需要的温度和溶液PH分别为:30℃、pH=2.0;反应温度过高,反应速率下降是因为升温使蛋白质发生变性,催化剂失去生理活性,
故答案为:30℃、pH=2.0;催化剂活性下降或催化剂在30℃时活性最大;
(2)此反应中氧气是氧化剂,每个氧分子得4e,Fe2+被氧化为Fe3+,根据电子守恒、原子守恒可知发生反应的化学方程式为![]() ,并用单线桥分析为
,并用单线桥分析为![]() ,
,
故答案为:![]() ;
;
(3)当![]() =4时,结合氧化还原反应电子守恒,4H2O28H2O8e,电子守恒得到H2S变化为+6价化合物,H2SH2SO48e,氧化产物的分子式为H2SO4,
=4时,结合氧化还原反应电子守恒,4H2O28H2O8e,电子守恒得到H2S变化为+6价化合物,H2SH2SO48e,氧化产物的分子式为H2SO4,
故答案为:H2SO4;
(4)过程①是二氧化硫和氢氧化钠溶液反应生成亚硫酸钠和水,反应的离子方程式为:2OH+SO2=SO32+H2O,
故答案为:2OH+SO2=SO32+H2O;
(5)过程②加入CaO,存在CaO(s)+H2O(l)═Ca(OH)2(s)Ca2+(aq)+2OH(aq),因SO32与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成,
故答案为:SO32与Ca2+生成CaSO3沉淀,平衡向正向移动,有NaOH生成;
(6)废气中每小时排放SO2为:1000L/m3×5m3/h×0.2%=10L/h,氨气与SO2气体的速度比值为:v(NH3):v(SO2)=2:1时NH3与SO2完全转化为(NH4)2SO4,即需要将NH3速率控制在20L/h,
故答案为:废气每小时排放SO2为:1000L/m3×5m3/h×0.2%=10L/h,氨气与SO2气体的速率比值符合2:1,两者完全转化为(NH4)2SO4。

 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案