题目内容
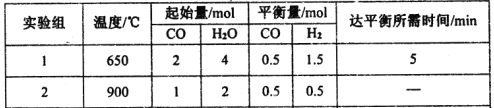
【题目】铜器久置于空气中会和空气中的水蒸气、CO2、O2作用产生“绿锈”,该“绿锈”俗称“铜绿”,又称“孔雀石”[化学式为Cu2(OH)2CO3],“铜绿”能跟酸反应生成铜盐和CO2、H2O。某同学利用下述系列反应实现了“铜→铜绿→……→铜”的转化。
![]()
(1)从三种不同分类标准回答,“铜绿”属于哪类物质? _。
(2)请写出铜绿与盐酸反应的化学方程式: 。
(3)写出B的化学式 。
(4)上述转化过程中属于化合反应的是 ,属于复分解反应的是 (填序号)。
(5)写出①反应的化学方程式 。
【答案】(1)铜盐、碳酸盐、碱式盐、盐、化合物(任意三种);(2)Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O;(3)CuO ; (4)①,②③;(5)2Cu+O2+CO2+H2O===Cu2(OH)2CO3。
【解析】
试题分析:(1)铜绿是Cu2(OH)2CO3,根据盐的分类,可以分为铜盐、碳酸盐、碱式盐、化合物等;(2)根据题中信息,和酸反应生成铜盐、CO2、H2O,因此反应方程式为:Cu2(OH)2CO3+4HCl===2CuCl2+CO2↑+3H2O;(3)反应④加热,使氢氧化铜分解成CuO,则B为CuO;(4)反应①为化合反应、反应②为复分解反应、反应③加入NaOH溶液发生复分解反应、反应④是分解反应、反应⑤是置换反应,因此化合反应是①,复分解反应为②③;(5)反应方程式为:2Cu+O2+CO2+H2O===Cu2(OH)2CO3。

【题目】常温下,将某一元酸HA溶液和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液的pH |
① | 0.1 | 0.1 | pH=9 |
② | c | 0.2 | pH=7 |
③ | 0.2 | 0.1 | pH<7 |
(1)在①组实验中0.1 mol·L-1HA溶液中水的电离程度为a,0.1 mol·L-1NaOH溶液中水的电离程度为b,所得混合溶液中水的电离程度为c.则a、b、c由大到小的顺序是_________.
(2)在②组实验中c_____0.2(填“<”、“>”或“=”)
(3)根据③组实验所得的混合溶液,其溶液中离子浓度大小排列顺序是____________.
(4)常温下,已知KSP[Cu(OH)2]=2×10-20,某CuSO4溶液里c(Cu2+)=0.02 mol·L-1,如果要生成Cu(OH)2沉淀,则应调整溶液pH大于_________.
【题目】分析下表中各项的排布规律,按此规律排布第23项应为( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
A.C9H18 B.C9H118O2 C.C8H18 D.C8H16O2