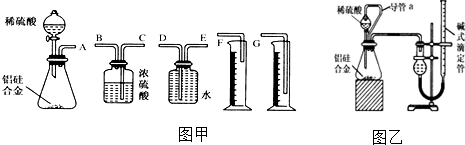
题目内容
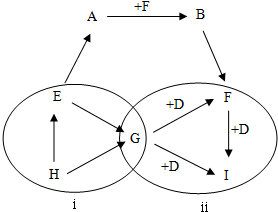
1.图中A~I表示几种初中化学常见的物质,“→”表示物质间存在相应的转化关系,部分反应物、生成物及反应条件已略去.已知圈i中的转化均是分解反应.圈ⅱ中的转化均是化合反应.D和G是常见的非金属单质,组成化合物E和H的元素种类相同.组成化合物F和I的元素种类也相同,A常用来中和土壤的酸性.(1)写出化学式:ACa(OH)2BCaCO3 DC
(2)写出B→F的化学反应方程式:CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑
(3)写出G→I的化学反应方程式:2C+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CO.
分析 根据题干提供的信息结合框图进行分析,此题的解题突破口在于A常用来中和土壤的酸性,则A是氢氧化钙,可由氧化钙和水反应生成,E和H的元素种类相同,且由H生成E是分解反应,则E可能是水,H可能是双氧水,E和H分解生成的G可能是氧气,能与D化合生成F和I,D是常见的非金属单质,则D可能是碳,生成的F能与氢氧化钙反应,则F可能是二氧化碳,生成的B可能是碳酸钙,I可能是一氧化碳,带入验证即可,据此答题.
解答 解:A常用来中和土壤的酸性,则A是氢氧化钙,可由氧化钙和水反应生成,E和H的元素种类相同,且由H生成E 是分解反应,则E可能是水,H可能是双氧水,E和H分解生成的G可能是氧气,能与D化合生成F和I,D是常见的非金属单质,则D可能是碳,生成的F能与氢氧化钙反应,则F可能是二氧化碳,生成的B可能是碳酸钙,代入框图,符合题意,所以A为氢氧化钙,B为碳酸钙,D为碳,E为水,F为二氧化碳,G为氧气,H为双氧水,I为一氧化碳,
(1)根据上面的分析可知,A为Ca(OH)2,B为CaCO3,D为C,
故答案为:Ca(OH)2;CaCO3;C;
(2)B为碳酸钙,F为二氧化碳,高温下,碳酸钙可分解生成氧化钙和二氧化碳,化学方程式为CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,
故答案为:CaCO3 $\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑;
(3)G为氧气,D为碳,碳在氧气不充足的条件下能生成一氧化碳,化学方程式为:2C+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CO,
故答案为:2C+O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CO.
点评 此题为框图式物质推断题,完成此类题目,关键是找准解题突破口,直接得出结论,然后利用顺向或逆向或两边向中间推,逐一导出其他结论,题目难度中等.

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案| A. | 实验室采用排饱和食盐水的方法收集Cl2 | |
| B. | 500℃左右的温度比室温更有利于合成氨反应 | |
| C. | H2、I2、HI平衡混合气体加压后颜色加深 | |
| D. | SO2氧化为SO3,往往需要使用催化剂 |
| A. | 标准状况下,64gCu与足量浓硝酸反应恰好生成2NA个NO2分子 | |
| B. | 120gNaHSO4固体中含有NA个阳离子 | |
| C. | Si-O键的键能大于Si-Cl键的键能,因此SiO2的熔点高于晶体SiCl4的熔点 | |
| D. | CO和N2为等电子体,22.4L的CO气体与lmol N2所含的电子数相等 |
| A. | 硫酸的摩尔质量是98 | |
| B. | 摩尔是阿伏加德罗常数个微粒的集合体 | |
| C. | 6.02Х1023就是阿伏加德罗常数 | |
| D. | 氧气的摩尔质量(单位:g•mol-1)在数值上等于它的相对分子质量 |
| A. | 硅酸、氯化铁均为胶体 | B. | 水玻璃、氯水均为混合物 | ||
| C. | 食醋、纯碱、食盐分别属于酸、碱盐 | D. | 氨气属于非电解质,Cu属于电解质 |
| A. | 臭氧空洞、温室效应、光化学烟雾、硝酸型酸雨的形成都与氮氧化合物有关 | |
| B. | 石油裂解、煤的气化、海水制镁、纤维素制火棉等过程中都包含化学变化 | |
| C. | 低碳经济就是以低能耗、低污染、低排放为基础的经济发展模式 | |
| D. | 可用丁达尔效应鉴别氢氧化铁胶体和氯化铁溶液 |
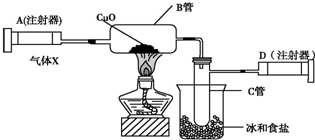
 Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验:
Na2O2与水的反应实际是Na2O2+2H2O═2NaOH+H2O2,反应放出的热量使部分H2O2受热分解:2H2O2═2H2O+O2↑.为了测定某过氧化钠固体的纯度,今做如下实验: