题目内容
【题目】为探究Na、Mg、Al活动性顺序,某课外小组同学进行了如下实验:
实验步骤 | 1.将一小块金属钠放入滴有酚酞溶液的冷水中。 2.将一小段用砂纸打磨后的镁带放入试管中,加入少量水,加热至水沸腾,冷却后,向试管中滴加酚酞溶液。 3.将一小段镁带投入稀盐酸中。 4.将一小片铝投入稀盐酸中。 |
他们记录的实验现象有:
实验现象 | ①剧烈反应,迅速生成大量的气体。 ②浮在水面上,熔成小球,不断游动,小球渐小最终消失,溶液变红。 ③反应不剧烈,产生无色气体。 ④有气体产生,溶液变成红色。 |
请帮助该小组同学补充下列实验报告中的内容。
(1)在下表中填写与实验步骤相对应的实验现象序号。
实验步骤 | 1 | 2 | 3 | 4 |
实验现象 | _____ | _____ | _____ | _____ |
(2)写出镁与水反应的化学方程式: _____。
(3)实验结论是: Na、Mg、Al金属性逐渐_____。
(4)用原子结构理论对上述实验结论进行解释:同周期元素从左至右,原子的电子层数相同,核电荷数逐渐增多,原子半径逐渐_____,原子核对电子的引力逐渐增强,失电子能力逐渐减弱,因此_____逐渐减弱。
【答案】② ④ ① ③ Mg+2H2O![]() Mg(OH)2+H2↑ 减弱 减小 金属性
Mg(OH)2+H2↑ 减弱 减小 金属性
【解析】
同周期主族元素自左至右金属性减弱,核外电子层数相同,但核电荷数依次增大,对核外电子的吸引力增强,所以失电子的能力减弱,即活泼性(还原性)减弱。
(1)金属活动性Na>Mg>Al,金属越活泼与水或酸反应时越剧烈,越不活泼,越难置换出水或酸中的氢,所以:1对应的现象为②、2对应的现象为④、3对应的现象为①、4对应的现象为③;
(2)镁与沸水反应生成氢氧化镁和氢气,方程式为Mg+2H2O![]() Mg(OH)2+H2↑;
Mg(OH)2+H2↑;
(3)根据金属和酸以及水的反应的剧烈程度,可以知道Na、Mg、Al金属性逐渐减弱;
(4)同周期元素从左到右核电荷数逐渐增多,原子半径逐渐减小,原子核对核外电子的吸引力逐渐增强,失电子能力逐渐减弱,金属性逐渐减弱。

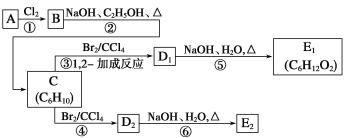
【题目】用下图所示装置检验乙烯时不需要除杂的是( )

乙烯的制备 | 试剂X | 试剂Y | |
A | CH3CH2Br与NaOH乙醇溶液共热 | 水 | Br2的CCl4溶液 |
B | CH3CH2Br与NaOH乙醇溶液共热 | 水 | KMnO4酸性溶液 |
C | C2H5OH与浓H2SO4 | NaOH溶液 | KMnO4酸性溶液 |
D | C2H5OH与浓H2SO4 | NaOH溶液 | Br2的CCl4溶液 |
【题目】苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸。反应原理:
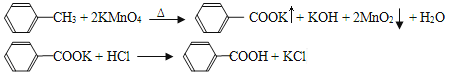
己知甲苯的熔点为-95°C,沸点为110.6°C,易挥发,密度为0.866g/cm3;苯甲酸的熔点为122.4°C,在25°C和95°C下溶解度分别为0.3g和6.9g。
【制备产品】将30.0mL甲苯和25.0mLlmol/L高锰酸钾溶液在100°C下反应30min,装置如图所示。
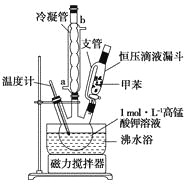
(1)图中冷凝管的进水口为________(填“a”或“b”)。支管的作用是___________。
(2)在本实验中,三领烧瓶最合适的容积___________(填字母)。
A.50mL | B.I00mL | C.200mL | D.250mL |
相对于用酒精灯直接加热,用沸水浴加热的优点是___________________。
【分离产品】该同学设计如下流程分离粗产品苯甲酸和回收甲苯
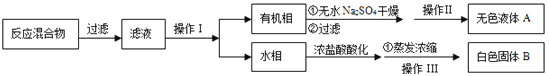
(3)操作Ⅰ的名称是 ;含有杂志的产物经操作Ⅱ进一步提纯得无色液体甲苯,则操作Ⅱ的名称是 。
(4)测定白色固体的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确。请完成表中内容。
序号 | 实验方案 | 实验现象 | 结论 |
① | 将白色固体加入水中,加热溶解,______。 | 得到白色晶体和无色溶液 | |
② | 取少重滤液于试管中,________。 | 生成白色沉淀 | 滤液含Cl- |
③ | 干燥白色晶体,________。 | _____________________ | 白色晶体是苯甲酸 |
纯度测定:称取1.220g产品,配成100ml甲醇溶液,取25.00ml溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
第一次 | 第二次 | 第三次 | 第四 | |
体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
(5)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果______________(填“偏大”、“偏小”或“不变”)。计算样品中苯甲酸纯度为______________。