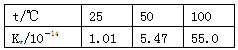
题目内容
下列理解不正确的是( )。
| A.化学平衡是一个动态平衡 |
| B.化学平衡研究的对象主要是可逆反应 |
| C.化学反应速率是研究化学反应进行的快慢问题,化学平衡是研究化学反应进行的限度问题 |
| D.化学反应达到平衡时,正反应和逆反应速率相等,是对反应中不同物质而言 |
D
解析

练习册系列答案
相关题目
下列措施不能增大反应速率的是
| A.锌与稀硫酸反应时,加少量铜粉 |
| B.Fe与稀硫酸反应制取H2时,改用98%浓硫酸 |
| C.Al在氧气中燃烧生成A12O3,将铝片改成铝粉 |
| D.恒温时,增大H2(g)+Br2(g) ?2HBr(g)反应体系的压强 |
对于①需加热才发生的反应、②放热反应、③熵增加的反应,可能属于自发反应的是
| A.只有② | B.只有③ | C.只有②③ | D.①②③ |
石墨、金刚石燃烧的热化学方程式分别为:
C(石墨,s)+O2(g) CO2(g) ΔH="-393.51" kJ·mol-1
CO2(g) ΔH="-393.51" kJ·mol-1
C(金刚石,s)+O2(g) CO2(g) ΔH="-395.41" kJ·mol-1
CO2(g) ΔH="-395.41" kJ·mol-1
关于金刚石和石墨的相互转化,下列说法正确的是( )
| A.石墨转化成金刚石是自发进行的过程 |
| B.金刚石转化成石墨是自发进行的过程 |
| C.金刚石比石墨更稳定 |
| D.金刚石比石墨能量低 |
某温度时,浓度都是1 mol·L-1的两种气体X2和Y2,在密闭容器中发生可逆反应生成气体Z,充分反应后X2的浓度为0.4 mol·L-1,Y2的浓度为0.8 mol·L-1,生成的Z的浓度为0.4 mol·L-1,则该反应的化学方程式(Z用X、Y表示)是( )
A.X2+2Y2 2XY2 2XY2 | B.2X2+Y2 2X2Y 2X2Y |
C.X2+3Y2 2XY3 2XY3 | D.3X2+Y2 2X3Y 2X3Y |
2SO2(g)+O2(g)  2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
| | 甲 | 乙 | 丙 | 丁 | |
| 起始物质的量 | n(SO2)/mol | 0.40 | 0. 40 | 0.80 | 0 |
| n(O2)/mol | 0.24 | 0.48 | 0.48 | 0.04 | |
| n(SO3)/mol | 0 | 0 | 0 | 0.40 | |
| 含硫反应物的平衡转化率/% | 80 | α1 | α2 | α3 | |
下列判断中,正确的是( )
A.丁中SO3的平衡转化率为α3=80%
B.该温度下,平衡常数的值为400
C.平衡时,丙中c(SO3)是甲中的2倍
D.平衡时,甲中O2的转化率小于乙中O2的转化率
一定温度下,对于反应N2+O2 2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
2NO在密闭容器中进行,下列措施能增大反应速率的是 ( )。
| A.缩小体积使压强增大 | B.恒容,充入N2 |
| C.恒容充入氦气 | D.恒压充入氦气 |
 xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是 ( )
xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法正确的是 ( )