题目内容
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
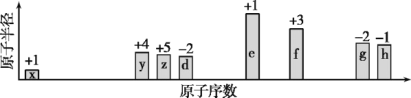
根据判断出的元素回答问题:
(1)h在周期表中的位置是_______。
(2)比较d、f离子半径大小(用化学式表示,下同):_>_。g、h的最高价氧化物对应水化物的酸性强弱:__ >__。
(3)h的单质与e的最高价氧化物对应水化物反应的离子方程式:____。
【答案】第三周期第ⅦA族 r(O2-) r(Al3+) HClO4 H2SO4 Cl2+2OH-=Cl- +ClO-+H2O
【解析】
根据图中八种短周期元素原子半径的相对大小,最高正价或最低负价的变化,判断出x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素,根据元素周期律以及元素的性质进行答题。
由分析可知:x是H元素,y是C元素,z是N元素,d是O元素,e是Na元素,f是Al元素,g是S元素,h是Cl元素。
(1)h是Cl元素,在元素周期表中位于第三周期第ⅦA族,故答案为:第三周期第ⅦA族。
(2)d是O元素、f是Al元素,O2-和Al3+的核外电子排布相同,核电荷数越大,半径越小,故r(O2-)>r(Al3+);元素的非金属性越强,最高价氧化物对应水化物的酸性越强,非金属性:Cl>S,故酸性:HClO4>H2SO4,故答案为:r(O2-),r(Al3+),HClO4,H2SO4。
(3)h是Cl元素,e是Na元素,Na的最高价氧化物对应水化物为NaOH,Cl2与NaOH溶液反应生成氯化钠、次氯酸钠和水,化学方程式为:Cl2+2NaOH═NaCl+NaClO+H2O,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O。