题目内容
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.(1)工业上用水煤气法制氢气,有关化学方程式是:
反应一:C(s)+H2O(g)?CO(g)+H2(g)△H>0
反应二:CO(g)+H2O(g)?CO2(g)+H2(g)△H<0
①若反应一在t℃时达到化学平衡状态,则此温度下该反应的平衡常数表达式K=
| c(CO)c(H2) |
| c(H2O) |
| c(CO)c(H2) |
| c(H2O) |
②在427℃时将CO 和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状态,该反应的平衡常数是9,则CO的转化率是
75%
75%
,用CO的浓度变化表示的反应率速v(CO)是7.5×10-4
7.5×10-4
mol/(L?min).(2)利用电解饱和食盐水也可制得氢气,图为电解食盐水的示意图:请回答:
①C1电极是
阳
阳
极(填“阴”或“阳”),C2电极的电极反应式是2H++2e-=H2↑
2H++2e-=H2↑
.②该电解反应的离子方程式是
2Cl-+2H2O=Cl2↑+H2↑+2OH-
2Cl-+2H2O=Cl2↑+H2↑+2OH-
,(3)通过下列方法也可以得到氢气.
已知:CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=-247.4kJ?mol-1
1molCH4(g)与H2O(g)反应生成CO2(g)和H2(g)的反应热是
+659.8
+659.8
kJ?mol-1.分析:(1)①依据化学方程式和平衡常数概念分析判断;
②依据化学平衡三段式列式计算,结合转化率、反应速率概念计算得到;
(2)①分析装置图可知C1为阳极溶液中氯离子失电子生成氯气,C2为阴极溶液中氢离子得到电子生成氢气;
②依据电解原理分析判断反应产物,电解饱和食盐水是氯化钠和水反应生成氯气和氢气和氢氧化钠;
(3)阳极热化学方程式和盖斯定律计算得到所需热化学方程式分析判断.
②依据化学平衡三段式列式计算,结合转化率、反应速率概念计算得到;
(2)①分析装置图可知C1为阳极溶液中氯离子失电子生成氯气,C2为阴极溶液中氢离子得到电子生成氢气;
②依据电解原理分析判断反应产物,电解饱和食盐水是氯化钠和水反应生成氯气和氢气和氢氧化钠;
(3)阳极热化学方程式和盖斯定律计算得到所需热化学方程式分析判断.
解答:解:(1)①C(s)+H2O(g)?CO(g)+H2(g),注意碳为固体,由反应的化学方程式可知平衡常数表达式K=
,
故答案为:
;
②在427℃时将CO 和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状态,该反应的平衡常数是9,设CO的转化率是x依据三段式列式得到:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 0.01 0.01 0 0
变化量(mol) 0.01x 0.01x 0.01x 0.01x
平衡量(mol)0.01-0.01x 0.01-0.01x 0.01x 0.01x
K=
=9
x=0.75=75%;
用CO的浓度变化表示的反应率速v(CO)=
=7.5×10-4 mol/L?min;
故答案为:75%;7.5×10-4 ;
(2)①分析装置图可知,阳离子移向C2电极为阴极,C1为阳极溶液中氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,C2为阴极溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,
故答案为:阳;2H++2e-=H2↑;
②C1为阳极溶液中氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,C2为阴极溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;
电池反应的离子方程式为:2Cl-+2H2O=
Cl2↑+H2↑+2OH-;
故答案为:2Cl-+2H2O=
Cl2↑+H2↑+2OH-;
(3)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=-247.4kJ?mol-1
1molCH4(g)与H2O(g)反应生成CO2(g)和H2(g)的反应依据盖斯定律①×2-②得到:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8kJ?mol-1,
反应热是+659.88kJ?mol-,
故答案为:+659.8.
| c(CO)c(H2) |
| c(H2O) |
故答案为:
| c(CO)c(H2) |
| c(H2O) |
②在427℃时将CO 和H2O(g)各0.01mol通入体积为2升的密闭容器中反应,5分钟时达到平衡状态,该反应的平衡常数是9,设CO的转化率是x依据三段式列式得到:
CO(g)+H2O(g)?CO2(g)+H2(g)
起始量(mol) 0.01 0.01 0 0
变化量(mol) 0.01x 0.01x 0.01x 0.01x
平衡量(mol)0.01-0.01x 0.01-0.01x 0.01x 0.01x
K=
| (0.01x)2 |
| (0.01-0.01x)2 |
x=0.75=75%;
用CO的浓度变化表示的反应率速v(CO)=
| ||
| 5min |
故答案为:75%;7.5×10-4 ;
(2)①分析装置图可知,阳离子移向C2电极为阴极,C1为阳极溶液中氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,C2为阴极溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑,
故答案为:阳;2H++2e-=H2↑;
②C1为阳极溶液中氯离子失电子生成氯气,电极反应为:2Cl--2e-=Cl2↑,C2为阴极溶液中氢离子得到电子生成氢气,电极反应为:2H++2e-=H2↑;
电池反应的离子方程式为:2Cl-+2H2O=
| ||
故答案为:2Cl-+2H2O=
| ||
(3)①CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.2kJ?mol-1
②CH4(g)+CO2(g)=2CO(g)+2H2(g)△H=-247.4kJ?mol-1
1molCH4(g)与H2O(g)反应生成CO2(g)和H2(g)的反应依据盖斯定律①×2-②得到:CH4(g)+2H2O(g)=CO2(g)+4H2(g)△H=+659.8kJ?mol-1,
反应热是+659.88kJ?mol-,
故答案为:+659.8.
点评:本题考查了化学平衡的计算中平衡常数、转化率、反应速率概念计算应用,电解原理分析,电极反应判断,热化学方程式和盖斯定律的计算应用,题目难度中等.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目


 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.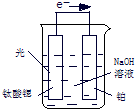 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.