题目内容
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.已知:CH4(g)+H2O(g)═CO (g)+3H2(g)△H=+206.2kJ?mol-1
CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ?mol-1
(1)以甲烷为原料制取氢气是工业上常用的制氢方法.CH4(g)与H2O(g)反应生成CO2(g)和H2(g)的热化学方程式为
CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kJ?mol-1
CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0kJ?mol-1
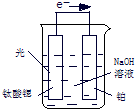
.(2)电解尿素[CO(NH2)2]的碱性溶液制氢的装置示意图见图(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极排出液中含有大量的碳酸盐成份,则阳极的电极反应式为
CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O
,每消耗1mol尿素需要补充2
2
mol氢氧化钾.分析:(1)根据已知的反应和目标反应,利用盖斯定律来计算反应热,并书写热化学反应方程式;
(2)由阳极排出液中含有大量的碳酸盐成份,则尿素在阳极参与反应,N元素的化合价升高,以此来书写电极反应;利用总反应来分析尿素与KOH的关系来解答.
(2)由阳极排出液中含有大量的碳酸盐成份,则尿素在阳极参与反应,N元素的化合价升高,以此来书写电极反应;利用总反应来分析尿素与KOH的关系来解答.
解答:解:(1)①CH4(g)+H2O(g)═CO (g)+3H2(g)△H=+206.2kJ?mol-1,
②CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ?mol-1,
由盖斯定律可知,①×2-②可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),
其反应热△H=(+206.2kJ?mol-1)×2-(+247.4kJ?mol-1)=+165.0 kJ?mol-1,
即热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ?mol-1;
(2)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,
由图可知,阴极生成氢气,则阴极反应为6H2O+6e-═3H2↑+6OH-,总反应为CO(NH2)2+2KOH═K2CO3+N2↑+3H2↑,显然每消耗1mol尿素需要补充2molKOH,
故答案为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O;2.
②CH4(g)+CO2(g)═2CO (g)+2H2(g)△H=+247.4kJ?mol-1,
由盖斯定律可知,①×2-②可得CH4(g)+2H2O(g)═CO2(g)+4H2(g),
其反应热△H=(+206.2kJ?mol-1)×2-(+247.4kJ?mol-1)=+165.0 kJ?mol-1,
即热化学方程式为CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ?mol-1,
故答案为:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+165.0 kJ?mol-1;
(2)由阳极排出液中含有大量的碳酸盐成份,尿素在阳极参与反应,则阳极反应式为CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O,
由图可知,阴极生成氢气,则阴极反应为6H2O+6e-═3H2↑+6OH-,总反应为CO(NH2)2+2KOH═K2CO3+N2↑+3H2↑,显然每消耗1mol尿素需要补充2molKOH,
故答案为:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O;2.
点评:本题考查盖斯定律、原电池的工作原理,学生应学会利用习题中的信息结合所学的知识来解答,难度不大,注意对高考热点的训练.

练习册系列答案
相关题目
 氢气是一种清洁能源,可以通过多种方法制得.
氢气是一种清洁能源,可以通过多种方法制得.

 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.