��Ŀ����
����Ŀ������β���к���CO��NO���к����塣
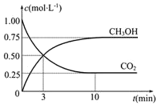
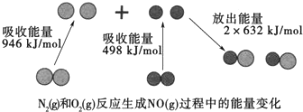
��1������β����NO���ɹ��̵������仯��ͼʾ��1molN2��1molO2��ȫ��Ӧ����NO��____�����������������ų�����____kJ������
��2��ͨ��NO�������ɼ������β����NO�ĺ������乤��ԭ����ͼ��ʾ������ʾ��O2-���ڴ˹��������������ƶ���
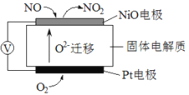
��NiO�缫�Ϸ�������___________��Ӧ������������������ԭ������
�����·�У������Ǵ�_________�缫����������NiO������Pt������
��Pt�缫�ϵĵ缫��ӦʽΪ________________________��
��3��һ�����ʹ�������NO��CO�ķ�Ӧ��2NO+2CO![]() 2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
2CO2+N2����֪��������ıȱ��������߸÷�Ӧ���ʣ�Ϊ����֤�¶ȡ������ıȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ijͬѧ���������ʵ�飬���������Ѿ������±��С�
ʵ���� | t���棩 | NO��ʼŨ�� ��mol/L�� | CO��ʼŨ�ȣ�mol/L�� | �����ıȱ������m2/g�� |
�� | 280 | 1.2��10��3 | 5.80��10��3 | 82 |
�� | 280 | 1.2��10��3 | b | 124 |
�� | 350 | a | 5.80��10��3 | 82 |
���뽫�������ݲ���������a ___________��
������֤�¶ȶԻ�ѧ��Ӧ���ʹ��ɵ���ʵ��____________����ʵ����ţ���
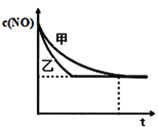
��ʵ����ʵ����У�NO�����ʵ���Ũ��c��NO����ʱ��t�ı仯������ͼ��ʾ�����б�ʾʵ����������_______����������������������
��4�����ݻ��̶��ľ��������з�����Ӧ2NO+2CO![]() 2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
2CO2+N2������˵���Ѵﵽƽ��״̬����________��������ѡ��
A�������ڻ�������¶Ȳ��ٱ仯 B�������ڵ�����ѹǿ���ֲ���
C��2����(NO)=����(N2) D�������ڻ�������ܶȱ��ֲ���
���𰸡����� 180 ���� NiO O2+4e��=2O2�� 1.2��10��3 ������ �� CD
��������
��1����ͼ��֪��1molN2��1molO2��ȫ��Ӧ����NOʱ�����յ����������ڷų������������÷�ӦΪ���ȷ�Ӧ��
��2��ԭ��ع���ʱ���������������ƶ������������ƶ��������ӵĶ����ƶ���֪NiO��Ϊԭ��صĸ�����Pt��Ϊԭ��ص�����������������ԭ��Ӧ����������������Ӧ��
��3���������֪����ʵ��Ŀ��֤�¶ȡ������ȱ�����Ի�ѧ��Ӧ���ʵ�Ӱ����ɣ�ʵ��ʱӦע������������ͬ������£������жϱ��������ʵ�Ӱ�죬Ҫ��֤�¶ȶ����ʵ�Ӱ�죬�����ıȱ��������Ӧ��ij�ʼŨ�ȵ�Ҫ��ͬ��ͬ����֤�����ıȱ���������ʵ�Ӱ�죬�¶ȡ���Ӧ��ij�ʼŨ��Ҫ��ͬ��
��4����һ�������£������淴Ӧ������Ӧ���ʺ��淴Ӧ�������ʱ������Ϊ0������Ӧ��ϵ�и������ʵ�Ũ�Ȼ������ٷ����仯��״̬����Ϊ��ѧƽ��״̬��
��1����ͼ��֪��1molN2��1molO2��ȫ��Ӧ����NOʱ����Ӧ�ﻯѧ���ƻ����յ�������Ϊ946kJ +498kJ=1444kJ���������γɻ�ѧ���ų���������Ϊ2��632kJ=1264kJ����Ӧʱ��Ҫ����180kJ���������ʴ�Ϊ�����գ�180��
��2����ԭ����У�NiOΪ�������缫��NOʧ���ӷ���������Ӧ���ɶ����������ʴ�Ϊ��������
�����·�У������ɸ���NiO����������������������Pt�����ʴ�Ϊ��NiO��
��ԭ����У�Pt�缫Ϊ������ O2�������Ϸ�����ԭ��Ӧ����O2-���缫��ӦʽΪO2+4e��=2O2�����ʴ�Ϊ��O2+4e��=2O2����
��3�����ɱ������ݿ�֪��ʵ����¶���ͬ�������ıȱ������ͬ��ʵ��Ŀ������֤�����ıȱ���������ʵ�Ӱ�죬���¶Ⱥͷ�Ӧ��ij�ʼŨ��Ҫ��ͬ��ʵ��I��������ıȱ������ͬ���¶Ȳ�ͬ��ʵ��Ŀ������֤�¶ȶ����ʵ�Ӱ�죬��Ӧ��ij�ʼŨ��Ҫ��ͬ��aӦ��Ϊ1.2��10��3mol/L���ʴ�Ϊ��1.2��10��3��
���ɱ������ݿ�֪��ʵ��I��������ıȱ������ͬ���¶Ȳ�ͬ��ʵ��Ŀ������֤�¶ȶ����ʵ�Ӱ�죬�ʴ�Ϊ����͢�
���������ıȱ������ͬ���¶���ͬ����Ӧ��ij�ʼŨ�ȣ������ıȱ������ƽ���ƶ���Ӱ�죬��������ʴ��ȴﵽ��ѧƽ�⣬��ʵ���ѡ�����ң��ʴ�Ϊ���ң�
��4��A����Ӧ�ھ��������н��У������ڻ�������¶Ȼ�仯�����¶Ȳ��ٱ仯ʱ��˵����Ӧ�Ѵﵽƽ�⣻
B���÷�Ӧ��һ�����������С�ķ�Ӧ���������ڵ�����ѹǿ���ֲ��䣬˵�����淴Ӧ������ȣ���Ӧ�Ѵﵽƽ�⣻
C����Ӧ�Ѵﵽƽ�⣬���淴Ӧ������ȣ�����(NO)= 2����(N2)��2����(NO)=����(N2)˵����Ӧû�дﵽƽ��״̬��
D���������غ㶨�ɿ�֪����Ӧǰ�������������䣬������������䣬�������ڻ�������ܶ�һֱ���ֲ��䣬���������ܶȲ��䲻��˵����Ӧ�Ѵﵽƽ�⣻
����˵����Ӧ�Ѵ�ƽ��״̬��ΪCD���ʴ�Ϊ��CD��

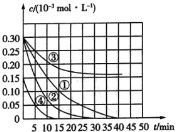
����Ŀ����![]() ��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
��Һ������ˮ�еĻ�ԭ����Ⱦ��M��Ϊ�о��併��Ч����������¶Ա�ʵ��̽���¶ȡ�Ũ�ȡ�pH�Խ������ʺ�Ч����Ӱ�죬ʵ����M��Ũ�ȱ仯��ʱ��Ĺ�ϵ��ͼ��ʾ������˵������ȷ���ǣ� ��
ʵ���� | �¶ȣ�K�� | pH |
�� | 298 | 1 |
�� | 310 | 1 |
�� | 298 | 7 |
�� | 298 | 1 |
A.ʵ�����15min��M�Ľ�������Ϊ![]()
B.������������ͬ��ʵ��٢�˵�������¶ȣ�M������������
C.������������ͬ��ʵ��٢�֤��pHԽ�ߣ�Խ������M�Ľ���
D.������������ͬ��ʵ��٢�˵��M��Ũ��ԽС�����������Խ��