题目内容
【题目】
向盛有硫酸铜水溶液的试管里加入氨水,首先形成蓝色沉淀,继续添加氨水,沉淀溶解病得到深蓝色的透明液体;若向试管中加入一定量乙醇,析出深蓝色晶体。结合有关知识,回答下列问题:
(1)Cu、N、O、S元素第一电离能由大到小的顺序是_______(填元素符号);蓝色沉淀溶解时发生反应的离子方程式是________________。
(2)请解释加入乙醇后析出晶体的原因______________。
(3)SO42-的空间构型是_____________,其中S原子的杂化轨道类型是___________。
(4)NH3、H2O分子中,键角的大小顺序为_______(用分子式表示);NH3极易溶于H2O的原因,除了两种分子都是极性分子外,还因为_______________。
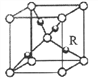
(5)Cu和O能形成一种化合物,其晶胞结构如图所示,则R所表示微粒的价电子排布式为_____;若相邻的两不同微粒间的距离为a cm,设阿伏伽德罗常数的数值为NA,则该晶体的密度为_______(用含a、NA的代数式表示)g/cm3。
【答案】 N>O>S>Cu Cu(OH)2 + 4NH3 =[Cu(NH3)4]2++2OH- 乙醇分子极性比水分子极性弱,加入乙醇降低溶剂极性,从而减小溶质的溶解度 正四面体 sp3 NH3>H2O NH3与H2O分子间形成氢键,NH3与H2O发生化学反应 3d10 ![]()
【解析】(1)同一周期,从左到右,第一电离能逐渐增大,同一主族,从上到下,第一电离能逐渐减小,N原子的2p为半充满状态,较为稳定,第一电离能最大,第一电离能由大到小的顺序为N>O>S>Cu;蓝色沉淀氢氧化铜被氨水溶解时发生反应的离子方程式为Cu(OH)2 + 4NH3 =[Cu(NH3)4]2++2OH-,故答案为:N>O>S>Cu ;Cu(OH)2 + 4NH3 =[Cu(NH3)4]2++2OH-;
(2) 乙醇分子极性比水分子极性弱,加入乙醇降低溶剂极性,从而减小溶质的溶解度,析出深蓝色晶体,故答案为:乙醇分子极性比水分子极性弱,加入乙醇降低溶剂极性,从而减小溶质的溶解度;
(3)SO42-中S原子的价层电子对数为4,空间构型是正四面体,其中S原子采用sp3杂化,故答案为:正四面体; sp3;
(4) NH3分子中每个氮原子杂化轨道数为4,所以采取sp3杂化,三角锥形,键角为107°;H2O分子中每个氧原子杂化轨道数为4,所以采取sp3杂化,为V形,键角为105°,键角:NH3>H2O;NH3与H2O都是极性分子,NH3与H2O分子间形成氢键,NH3与H2O发生化学反应都导致NH3极易溶于H2O,故答案为:NH3与H2O分子间形成氢键,NH3与H2O发生化学反应;
(5)根据晶胞的结构图可知,晶胞中含有氧原子数为1+8×![]() =2,铜原子数为4,所以该化合物的化学式为Cu2O,则R为Cu,Cu+的价电子排布式为3d10,晶胞质量为(4×
=2,铜原子数为4,所以该化合物的化学式为Cu2O,则R为Cu,Cu+的价电子排布式为3d10,晶胞质量为(4×![]() +2×
+2×![]() )g,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为
)g,若相邻氧原子和铜原子间的距离为a cm,则晶胞的体对角线为4acm,所以边长为![]() cm,所以体积为(
cm,所以体积为(![]() )3cm3,该晶体的密度为(4×
)3cm3,该晶体的密度为(4×![]() +2×
+2×![]() )g÷(
)g÷(![]() )3cm3=
)3cm3=![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。

【题目】Ca3N2某实验小组利用如下装置(部分固定装置略)进行氮气与钙的反应,并探究其产物的性质及化学式。请回答下列问题。

(1)仪器B的名称是_____________,B中固体物质为_______________。
(2)反应过程中末端导管必须插入试管C的水中,目的是______。(填字母)
A.吸收反应中剩余的氮气
B.控制通入气体的流速
C.防止空气中的氧气倒流进入反应装置,干扰反应
(3)将制备氮化钙的操作步骤补充完整:
①打开活塞K并通入N2;
②点燃酒精灯,进行反应;
③反应结束后,__________________。
(4)该小组同学认为根据相应的质量关系可以求出生成物的化学式,数据记录如下:
A的质量m0/g | A与钙的质量m1/g | A与产物的质量m2/g |
14.80 | 15.08 | 15.15 |
①通过计算得到化学式CaxN2,其中x=______。
②小组同学查阅资料得知产物为Ca3N2,能与水强烈反应,请写出Ca3N2与水反应的化学方程式_________________,设计实验检验Ca3N2与水反应产物的操作及现象__________________。
【题目】下列各组关于强电解质、弱电解质、非电解质的归类,完全正确的是( )
选项 | A | B | C | D |
强电解质 | Fe | NaCl | CaCO3 | HNO3 |
弱电解质 | CH3COOH | NH3 | H3PO4 | Fe(OH)3 |
非电解质 | 蔗糖 | BaSO4 | 酒精 | H2O |
