题目内容
相同温度下,体积均为0.25L的两个恒容密闭容器中发生可逆反应:
X2(g) + 3Y2(g)  2XY3(g) △H=-92.6 kJ·mol-1
2XY3(g) △H=-92.6 kJ·mol-1
实验测得反应在起始、达到平衡时的有关数据如下表所示:
| 容器 编号 | 起始时各物质物质的量/mol | 达平衡时体系能量的变化 | ||
| X2 | Y2 | XY3 | ||
| ① | 1 | 3 | 0 | 放热 23.15 kJ |
| ② | 0.6 | 1.8 | 0.8 | Q(Q>0) |
A.容器①、②中反应的平衡常数相等
B.容器②中反应达到平衡时放出的热量Q为23.15kJ
C.达平衡时,两个容器中XY3的物质的量浓度均为2 mol·L-1
D.若容器①体积为0.20 L,则达平衡时放出的热量大于23.15 kJ
B
解析试题分析:A.因为同一反应在相同的温度下的平衡常数不变,故容器①、②中反应的平衡常数相等,正确;B.容器②中反应可视为是容器①已经反应了一部分,故达到平衡时放出的热量Q<23.15kJ,原说法不正确;C.容器①、②中达平衡时的等效的,由①可知生成n(XY3)= ×2mol=0.5mol,故c(XY3)=
×2mol=0.5mol,故c(XY3)=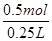 =2 mol·L-1,正确;D.若容器①体积为0.20 L,相当于原反应缩小体积,加压,平衡正向移动,故放出的热量大于23.15 kJ,正确。
=2 mol·L-1,正确;D.若容器①体积为0.20 L,相当于原反应缩小体积,加压,平衡正向移动,故放出的热量大于23.15 kJ,正确。
考点:同一反应不同的起始量达到的平衡数据比较。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案已知298 K时,合成氨反应N2(g)+3H2(g)  2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) ( )
2NH3(g) ΔH=-92.0 kJ·mol-1,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应。测得反应放出的热量为(假定测量过程中没有能量损失) ( )
| A.一定小于92.0 kJ | B.一定大于92.0 kJ |
| C.一定等于92.0 kJ | D.无法确定 |
某实验小组学生用50mL0.50mol/L的盐酸与50mL0.55mol/L的NaOH溶液在如图所示的装置中进行中和反应、通过测定反应过程中所放出的热量计算反应热.下列说法正确的是
| A.如图条件下实验过程中没有热量损失 |
| B.若改用60ml0.50mol/L盐酸跟50ml0.55mol/L的NaOH溶液进行反应,通过测定反应过程中所放出的热量相等 |
| C.图中实验装置缺少环形玻璃搅拌棒 |
| D.烧杯间填满碎纸条的作用是固定小烧杯。 |
已知:H(g) + H(g) = H2(g) ΔH=-435.7kJ/mol,此热化学方程式包含的意义是
| A.氢原子的能量比氢分子的能量低 |
| B.两个氢原子结合成一个氢分子时放出435.7kJ能量 |
| C.1mol氢分子分解成2mol氢原子要吸收435.7kJ能量 |
| D.2mol氢原子结合1mol氢分子成要吸收435.7kJ能量 |
下列依据相关数据作出的推理和判断中,不正确的是
| A.依据相对分子质量的数据,推测乙醇和丙烷沸点的相对高低 |
| B.依据溶解度的数据,选择用重结晶的方法可将粗苯甲酸提纯 |
| C.依据沸点的数据,判断用分馏的方法从石油中获取汽油和煤油等 |
| D.依据燃烧热的数据、热化学方程式和盖斯定律,可计算一些反应的反应热 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化:
下列说法正确的是( )
| A.1 mol N2(g)和1 mol O2(g)反应放出的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
已知:
2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+ O2(g) ΔH=-266 kJ·mol-1
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
| A.CO的燃烧热为283 kJ |
| B.下图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-532kJ·mol-1 |
| D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023 |


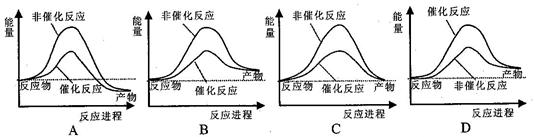
 2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是
2 CO2 (g) +S (g) ΔH= +8.0 kJ·mol-1的反应来减少污染,使用新型催化剂加快反应。下列有关该反应过程的能量变化示意图正确的是