题目内容
【题目】如图所示,常温下通电5 min后,发现铜电极的质量增加,试回答:
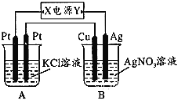
①电源电极X的名称为________(填“正极”或“负极”)。
②电解池B中阳极的电极反应式是________。
③若KCl溶液的体积是200 mL,则当铜电极的质量增加2.16g时A中溶液的pH=_____(忽略电解前后溶液体积的变化),若要使电解后的溶液恢复到与电解前完全相同的状态,则应加入____________(填物质的种类及数量)。
【答案】负极 Ag-e-=Ag+ 13 0.02molHCl或通入标况下0.448LHCl气体
【解析】
(1)常温下电解5min后,铜电极质量增加,则Cu电极是阴极,Ag电极是阳极,连接阳极的电极是电源正极、连接阴极的电极是电源负极;
(2)电解池B中阳极上银单质放电生成银离子;
(3)根据转移电子相等计算A中生成氢氧根离子浓度,从而计算溶液的pH,根据电极反应式分析.
(1)常温下电解5min后,铜电极质量增加,则Cu电极是阴极,Ag电极是阳极,连接阳极的电极是电源正极、连接阴极的电极是电源负极,所以X是电源负极、Y是电源正极;
(2)电解池B中阳极上银单质失去电子变为银离子,电极反应式为Ag-e-=Ag+;
(3)常温下电解5min后,铜电极质量增加2.16g,转移电子的物质的量n(e-) =n(Ag)=![]() =0.02mol,A中电池反应式为2KCl+2H2O
=0.02mol,A中电池反应式为2KCl+2H2O![]() Cl2↑+H2↑+2KOH,根据同一闭合回路中转移电子数目相等可知:c(KOH)=
Cl2↑+H2↑+2KOH,根据同一闭合回路中转移电子数目相等可知:c(KOH)=![]() =0.1mol/L,则溶液中c(H+)=
=0.1mol/L,则溶液中c(H+)=![]() mol/L=10-13mol/L,所以pH=13;
mol/L=10-13mol/L,所以pH=13;
若要使电解后的溶液恢复到与电解前完全相同的状态,反应转移0.02mol电子,消耗0.02molCl-,产生0.01molCl2、0.01molH2,考虑加入HCl,则需要加0.02molHCl,或通入HCl气体,其体积在标准状况下为V(HCl)=0.02mol×22.4L/mol=0.448L。

【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。

①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温
【题目】在25 ℃时,AgCl的白色悬浊液中,依次加入等浓度的KI溶液和Na2S溶液。观察到的现象是先出现黄色沉淀。最终出现黑色沉淀。已知有关物质的溶度积Ksp(25 ℃)如下:
AgCl | AgI | Ag2S | |
Ksp | 1.8×10-10 | 8.51×10-16 | 6.3×10-50 |
下列叙述错误的是( )
A.沉淀转化的实质就是沉淀溶解平衡的移动
B.溶解度小的沉淀可以转化为溶解度更小的沉淀
C.AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同
D.25 ℃时,在饱和AgCl、AgI、Ag2S溶液中,所含Ag+的浓度不同