题目内容
【题目】合成氨是人类科学技术上的一项重大突破,其反应原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ·mol-1
2NH3(g) ΔH=-92.4 kJ·mol-1
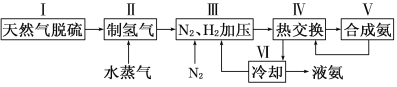
一种工业合成氨的简易流程图如下:
(1)在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是 。升高平衡体系的温度(保持体积不变),该反应 (填“逆向移动”正向移动”或“不移动”) 。
(2)氨水、氯水中均存在多种微粒和多个平衡,请写出氯水中存在的一个化学平衡反应的离子方程式 。
(3)步骤Ⅱ中制氢气原理如下:
①CH4(g)+H2O(g)![]() CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
CO(g)+3H2(g) ΔH=+206.4 kJ·mol-1
②CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1
对于反应①,一定可以提高平衡体系中H2百分含量,又能加快反应速率的措施是___________。
a.升高温度 b.增大压强
c.加入催化剂 d.降低压强
利用反应②,将CO进一步转化,可提高H2产量。若2 mol CO和H2的混合气体(H2的体积分数为80%)与H2O反应,得到2.28mol CO、CO2和H2的混合气体,则CO转化率为_____________。
【答案】(1)1:3 逆向移动
(2)Cl2+H2O![]() H++Cl-+HClO
H++Cl-+HClO
(3)a 70%
【解析】
试题分析:(1)
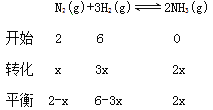
在密闭容器中,使2 mol N2和6 mol H2混合发生下列反应:N2(g)+3H2(g)![]() 2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是
2NH3(g)(正反应为放热反应)当反应达到平衡时,N2和H2的浓度比是![]() 。正反应放热,升高平衡体系的温度(保持体积不变), 该反应逆向移动;(2)氯水中存在的一个化学平衡反应的离子方程式Cl2+H2O
。正反应放热,升高平衡体系的温度(保持体积不变), 该反应逆向移动;(2)氯水中存在的一个化学平衡反应的离子方程式Cl2+H2O![]() H++Cl-+HClO;(3)要提高平衡体系中H2百分含量,需要平衡正向移动;升高温度,平衡正向移动,速率加快;增大压强,平衡逆向移动,速率加快;加入催化剂,平衡不移动,速率加快;降低压强,平衡正向移动,速率减慢;设参加反应的CO 的物质的量为xmol
H++Cl-+HClO;(3)要提高平衡体系中H2百分含量,需要平衡正向移动;升高温度,平衡正向移动,速率加快;增大压强,平衡逆向移动,速率加快;加入催化剂,平衡不移动,速率加快;降低压强,平衡正向移动,速率减慢;设参加反应的CO 的物质的量为xmol
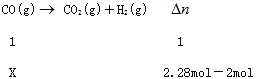
X=0.28mol;
则CO转化率为![]() 70%。
70%。

 出彩同步大试卷系列答案
出彩同步大试卷系列答案