题目内容
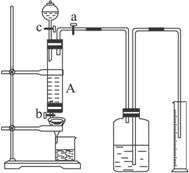
某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3?6H2O,并测定该废屑中铁的纯度,设计了下列实验装置图。A中放有m克废铁屑,烧杯中盛有过量的过氧化氢溶液。

完成下列问题:
(1)如何检查装置A的气密性: 。
(2)实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,观察到的现象是 ;滴加盐酸时,发现反应速率较相同浓度盐酸与铁粉反应要快,其原因是 。
(3)待A中的物质反应完成后,打开b,进行过滤,滤液过滤到盛有过氧化氢的烧杯中,发生反应的化学方程式为: 。
(4)要从烧杯内溶液得到FeCl3?6H2O晶体,主要操作包括:
(5)实验室若没有过氧化氢,可用下列 试剂代替(填选项)。
A.过量稀硝酸 B.过量氯水 C.过量氨水 D.过量氢氧化钠溶液
(6)若要测废铁屑中铁的纯度,测出放出气体的体积V(实验中导管体积忽略不计,已折算成标准状况,单位:L),则废铁屑纯度为 (用m、V的代数式表示)
(1)关闭a、b,打开c,向漏斗中加水至漏斗与管内出现液面差
(2)有气泡产生,溶液变为浅绿色,固体减少;形成原电池
(3)2FeCl2+2HCl+H2O2=2FeCl3+2H2O
(4)蒸发、降温、结晶(氯化氢气流中)
(5)B (6)![]()

练习册系列答案
 计算高手系列答案
计算高手系列答案
相关题目