题目内容
某同学利用废铁屑(含少量铜等不与盐酸反应的杂质)来制备FeCl3·6H2O,并测定该废铁屑中铁的纯度,设计了下列实验装置图。A中放有m克废铁屑,烧杯中盛有过量的过氧化氢溶液。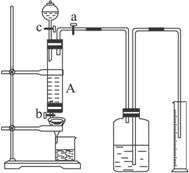
完成下列问题:
(1)如何检查装置A的气密性:__________________。
(2)实验时打开a,关闭b,从分液漏斗内向A中加过量的稀盐酸,观察到的现象是__________________________;滴加盐酸时,发现反应速率较相同浓度盐酸与铁粉反应要快,其原因是________________________________________________________________。
(3)待A中的物质反应完成后,打开b,进行过滤,滤液过滤到盛有过氧化氢的烧杯中,发生反应的化学方程式为:________________________________。
(4)要从烧杯内溶液得到FeCl3·6H2O晶体,主要操作包括:_________________________________________________。
(5)实验室若没有过氧化氢,可用下列 _________试剂代替(填选项)。
A.过量稀硝酸 B.过量氯水 C.过量氨水 D.过量氢氧化钠溶液
(6)若要测废铁屑中铁的纯度,测出放出气体的体积V(已折算成标准状况,单位:L),则废铁屑的纯度为 _________(用m、V的代数式表示)。
(1)在分液漏斗中装入水,按图安装好装置,关闭活塞a、b,打开活塞c,可以看到分液漏斗内的水逐滴滴下,过一会儿,就不再继续下滴,且分液漏斗的末端可观察到一段水柱,说明A装置不漏气(其他合理答案同样给分)
(2)有气泡产生,溶液呈浅绿色 铁与杂质铜形成原电池反应,加快了反应速率
(3)2FeCl2+H2O2+2HCl====2FeCl3+2H2O
(4)加热浓缩、冷却结晶、过滤;因为氯化铁是强酸弱碱盐,加热蒸干时,水解生成氢氧化铁和盐酸,HCl挥发,造成水解平衡右移,因此得不到FeCl3·6H2O晶体
(5)B (6)![]() ×100%
×100%
解析:(1)在分液漏斗中装入水,按图安装好装置,关闭活塞a、b,打开活塞c,可以看到分液漏斗内的水逐滴滴下,过一会儿,就不再继续下滴,且分液漏斗的末端可观察到一段水柱,说明A装置不漏气。(其他合理答案同样给分)
(2)有气泡产生,溶液呈浅绿色;铁与杂质铜形成原电池反应,加快了反应速率。
(3)2FeCl2+H2O2+2HCl====2FeCl3+2H2O
(4)加热浓缩、冷却结晶、过滤;因为FeCl3是强酸弱碱盐,加热蒸干时,水解生成Fe(OH)3和盐酸,HCl挥发,造成水解平衡右移,因此得不到FeCl3·6H2O晶体。
(5)B (6)![]() ×100%
×100%