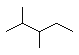
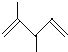
题目内容
【题目】完成下列填空。
(1)在 25℃、101kPa 时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为 393.5kJ/mol、285.8kJ/mol、870.3kJ/mol,则 2C(s)+2H2(g)+O2(g)= CH3COOH(l)的△H=___________。
(2)温度为 T 时,在 2 L 的密闭容器中加入 2.0 mol SO2 和 1.0 mol O2 发生反应,达到平衡时容器内气体压强变为起始时的 0.7 倍。该反应的平衡常数为_____。
(3)在一定体积 pH=12 的 Ba(OH)2 溶液中,逐滴加入一定物质的量浓度的 NaHSO4 溶液, 当溶液中的 Ba2+恰好完全沉淀时,溶液 pH=11。若反应后溶液的体积等于 Ba(OH)2 溶液与 NaHSO4 溶液的体积之和,则 Ba(OH)2 溶液与 NaHSO4 溶液____
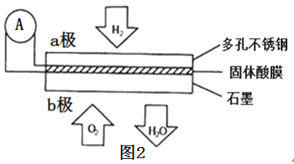
(4)利用如图所示的电解装置,可将雾霾中的 NO、SO2 转化为硫酸铵,从而实现废气的回 收再利用。通入 NO 的电极反应式为_____;若通入的 NO 体积为 4.48 L(标况下),则理论上另一电极通入 SO2 的物质的量应为_________。

【答案】-488.3kJ∕mol 1620 1:4 NO+6H++5e-=NH4++H2O 0.5mol
【解析】
根据燃烧热写出热化学方程式,再利用盖斯定律来计算反应2C(s)+2H2(g)+O2(g)= CH3COOH(l)的反应热;利用三段式法,设参加反应的SO2物质的量,用平衡状态时的压强变化列式求解,再用化学平衡公式求解化学平衡常数;氢氧化钡和硫酸氢钠反应钡离子恰好沉淀,需要Ba(OH)2和NaHSO4按照物质的量1:1和反应,结合溶液的pH和溶液体积换算物质的量列式计算;根据电解装置分析,通入NO的电极连接外电源负极,则该电极为电解池阴极,电解池阴极发生还原反应,NO转化为NH4+,H+参与电极反应,据此写出电极方程式,根据电子守恒计算。据此分析。
(1)在25℃、101kPa时,C(s)、H2(g)、CH3COOH(l)的燃烧热分别为393.5kJ∕mol、285.8kJ∕mol、870.3kJ∕mol,则H2(g)+![]() O2(g)=H2O(l) △H=-285.8kJ∕mol (1)
O2(g)=H2O(l) △H=-285.8kJ∕mol (1)
C(s)+O2(g)=CO2(g) △H=-393.5kJ∕mol (2)
CH3COOH(1)+2O2(g)=2CO2(g)+2H2O(l) △H=-870.3kJ∕mol(3)
由盖斯定律可以知道,(1)×2+(2)×2-(3)可得反应2C(s)+2H2(g)+O2(g)=CH3COOH(1),其反应热为2×(-285.8kJ∕mol)+2×(-393.5kJ∕mol)+870.3kJ∕mol=-488.3kJ∕mol,答案为:-488.3 kJ∕mol;
(2)温度为T时,在2L的密闭容器中加入2.0 mol SO2和1.0 mol O2发生反应,达到平衡时容器内气体压强变为起始时的0.7倍,用三段式法设反应的SO2的物质的量: ,该反应是恒温恒容下的反应,根据反应前后压强之比等于物质的量之比得
,该反应是恒温恒容下的反应,根据反应前后压强之比等于物质的量之比得![]() ,则化学平衡常数
,则化学平衡常数 ,答案为:1620;
,答案为:1620;
(3)pH=12的Ba(OH)2溶液中c(OH- )= 10-2mol∕L,设溶液体积为aL,则氢氧根离子物质的量为10-2×a mol;当溶液中的 Ba2+恰好完全沉淀时,根据反应Ba(OH)2+NaHSO4=BaSO4↓+H2O+NaOH,反应的硫酸氢钠物质的量为0.5a×10-2mol;设硫酸氢钠溶液体积为bL,混合后溶液pH=11,得溶液中氢氧根离子浓度为10 -3mol∕L,碱过量;根据公式得:![]() ,a:b=1:4;答案为:1:4;
,a:b=1:4;答案为:1:4;
(4)根据电解装置,SO2转化为硫酸根离子,说明NO转化为NH4+,即NO在阴极发生还原反应NO+6H++5e-=NH4++H2O,阳极反应式为SO2+2H2O-2e-=4H++SO42-,通入的 NO体积为 4.48 L(标况下)即0.2mol,根据得失电子守恒,因此有2NO~10e-~5SO2,则SO2的物质的量为0.5mol,答案为:NO+6H++5e-=NH4++H2O;0.5mol;

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】用下列实验方案及所选玻璃容器(非玻璃容器任选)就能实现相应实验目的的是
实验目的 | 实验方案 | 所选玻璃仪器 | |
A | 除去KNO3中少量NaCl | 将混合物制成热的饱和溶液,冷却结晶,过滤 | 酒精灯、烧杯、玻璃棒 |
B | 证明CH3COOH与HClO的酸性强弱 | 相同温度下用pH试纸测定浓度均为0.1 mol·L-1NaClO、CH3COONa溶液的pH | 玻璃棒、玻璃片 |
C | 配制1 L 1.6%的CuSO4溶液(溶液密度近似为1 g·mL-1) | 将25 g CuSO4·5H2O溶解在975 g水中 | 烧杯、量筒、玻璃棒 |
D | 检验蔗糖水解产物具有还原性 | 向蔗糖溶液中加入几滴稀硫酸,水浴加热几分钟,再向其中加入新制的银氨溶液,并水浴加热 | 试管、烧杯、酒精灯、滴管 |
A.AB.BC.CD.D