题目内容
【题目】科学家认为,氢气是21世纪一种高效而无污染的理想能源。
(1)为了有效发展氢能源,首先必须制得廉价的氢气,下列可供开发较经济且资源可持续利用的制氢气的方法是___。
A.电解水 B.锌和稀硫酸反应 C.催化光解海水 D.分解天然气
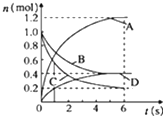
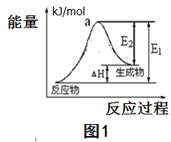
(2)用水分解获得氢气的能量变化如图1所示,则此反应的焓变△H=___kJ/mol。(请用关于E1,E2的代数式表示)。
(3)以甲烷为原料制取氢气是工业上常用的制氢方法。已知:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.2kJmol﹣1
CH4(g)+CO2(g)═2CO(g)+2H2(g) △H=+247.4kJmol﹣1
则CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=___kJmol﹣1
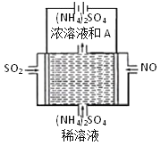
(4)某固体酸膜氢氧燃料电池以Ca(HSO4)2固体为电解质传递H+,其基本结构如图2所示,请按要求回答下列问题:

①b极上的电极反应式为___。
②此电池工作时每消耗4.48L(标准状况下)H2,转移电子___mol。
③若将这些电子用于铅蓄电池(两极板上分别覆盖有Pb、PbO2,电解质溶液是H2SO4溶液)充电,铅蓄电池中产生H2SO4的物质的量为___mol,铅蓄电池阳极发生的反应为___。
【答案】C (E1-E2) 165 O2+4H++4e-=2H2O 0.4 0.4 PbSO4+2H2O-2e-=PbO2+SO42-+4H+
【解析】
(1)开发较经济且资源可持续利用的制氢气方法要从能源消耗分析;
(2)催化剂能降低反应活化能;
(3)利用盖斯定律解答,从待求反应出发分析反应物、生成物在所给反应
(4)根据原电池工作原理进行分析解答;
(1)A.电解水需要大量的电能,不符合廉价的要求,故A错误;
B.锌和稀硫酸反应,消耗大量的锌和硫酸,不符合廉价的要求,故B错误;
C.光解海水,可充分利用光能,廉价而又低碳,符合要求,故C正确;
D.天然气不是可持续能源,故D错误;
故答案:C;
(2)根据用水分解获得氢气的能量变化如图可知,反应物的活化能为E1,生成物的活化能为E2,则此反应的焓变△H= (E1-E2) kJ/mol,故答案:(E1-E2);
(3)由已知:①CH4(g)+H2O(g)═CO(g)+3H2(g)△H=+206.2kJmol﹣1,②CH4(g)+CO2(g)═2CO(g)+2H2(g)△H=+247.4kJmol﹣1,根据盖斯定律:①![]() 2-②:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+206.2kJmol﹣1
2-②:CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=+206.2kJmol﹣1![]() 2-247.4kJmol﹣1=+165kJmol﹣1,故答案:+165;
2-247.4kJmol﹣1=+165kJmol﹣1,故答案:+165;
(4)①通入氧气的一极为电池的正极发生还原反应,电极反应式为O2+4H++4e-=2H2O,故答案为:O2+4H++4e-=2H2O;
②n(H2)=![]() =0.2mol,根据负极反应式H2-2e-=2H+可知,转移电子为0.2mol
=0.2mol,根据负极反应式H2-2e-=2H+可知,转移电子为0.2mol![]() 2=0.4mol,故答案:0.4;
2=0.4mol,故答案:0.4;
③给铅蓄电池充电时发生2PbSO4+2H2O=Pb+PbO2+2H2SO4,每生成2个H2SO4,转移电子数为2个,当转移0.4mol电子时,铅蓄电池中产生H2SO4的物质的量为0.4mol;阳极是PbSO4失去电子生成PbO2、SO42-、H+,发生氧化反应,阳极电极反应式为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,故答案为: 0.4 ;PbSO4+2H2O-2e-=PbO2+SO42-+4H+。