题目内容
【题目】某科研单位利用电化学原理用SO2来制备硫酸,装置如下图,含有某种催化剂。电极为多孔的材料,能吸附气体,同时也能使气体与电解质溶液充分接触。
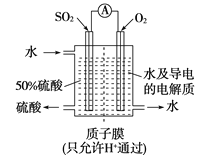
(1)通入SO2的电极为__________极,其电极反应式为_________________,此电极区pH_______(填“增大”“减小”或“不变”)。
(2)若通入SO2的速率为2.24 L/min(标准状况),为稳定持续生产,硫酸溶液的浓度应维持不变,则左侧水的流入速率是 (结果用 mL/min表示)
(3)以此电源电解足量的硝酸银溶液,若阴极产物的质量为21.6 g,则阳极产生气体标准状况下体积为__________L。
(4)常温时,BaSO4的Ksp=1.08×10-10。现将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合。若要生成BaSO4沉淀,BaCl2溶液的最小浓度为________。
(5)已知:Fe2O3(s)+3C(石墨)==2Fe(s)+3CO(g) ΔH =+489.0 kJ·mol-1
CO(g)+1/2O2(g)==CO2(g) ΔH=-283.0 kJ·mol-1
C(石墨)+O2(g)==CO2 (g) ΔH=-393.5 kJ·mol-1
则4Fe(s)+3O2(g)==2Fe2O3(s)的ΔH为___________。
【答案】(1)负,SO2-2e-+2H2O=SO![]() +4H+,减小;
+4H+,减小;
(2)13.4mL/min;(3)1.12;
(4)1.234×10-7mol/L(5)-1641.0kJ·mol-1。
【解析】
试题分析:分析图示知该装置为原电池,电池反应为2SO2+O2+2H2O![]() 2H2SO4。
2H2SO4。
(1)SO2失电子,发生氧化反应,故通入SO2的电极为负极,其电极反应式为SO2-2e-+2H2O=SO![]() +4H+,此电极区pH减小。
+4H+,此电极区pH减小。
(2)若通入SO2的速率为2.24 L/min(标准状况),则每分钟通入二氧化硫的物质的量为0.1mol,根据反应:2SO2+O2+2H2O![]() 2H2SO4知每分钟生成硫酸的物质的量为0.1mol,消耗氧气的物质的量为0.05mol,消耗水的物质的量为0.1mol。若硫酸溶液的浓度维持不变,设加入水的质量为x,则有98/(6.4+1.6+x)=50%,解得x=11.6g,而左则加入的水的质量为11.6+1.8=13.4g,则左侧水的流入速率是13.4 mL/min。
2H2SO4知每分钟生成硫酸的物质的量为0.1mol,消耗氧气的物质的量为0.05mol,消耗水的物质的量为0.1mol。若硫酸溶液的浓度维持不变,设加入水的质量为x,则有98/(6.4+1.6+x)=50%,解得x=11.6g,而左则加入的水的质量为11.6+1.8=13.4g,则左侧水的流入速率是13.4 mL/min。
(3)以惰性电极电解足量的硝酸银溶液,阴极反应为:Ag++e-![]() Ag,阳极反应为4OH--4e-
Ag,阳极反应为4OH--4e-![]() 2H2O+O2↑。生成银的质量为21.6 g,物质的量为0.2mol,转移的电子为0.2mol,根据电子守恒知阳极产生氧气的物质的量为0.05mol,标准状况下体积为1.12L。
2H2O+O2↑。生成银的质量为21.6 g,物质的量为0.2mol,转移的电子为0.2mol,根据电子守恒知阳极产生氧气的物质的量为0.05mol,标准状况下体积为1.12L。
(4)将等体积的BaCl2溶液与3.5×10-3mol/L的Na2SO4溶液混合,混合液中硫酸根浓度为1.75×10-3mol/L,又常温时,BaSO4的Ksp=c(Ba2+)c(SO42—)=1.08×10-10,则混合液中钡离子浓度为(1.08×10-10)÷1.75×10-3=0.617×10-7mol/L,则原BaCl2溶液的最小浓度为1.234×10-7 mol/L 。
(5)已知:①Fe2O3(s)+3C(石墨)==2Fe(s)+3CO(g) ΔH=+489.0 kJ·mol-1;
②CO(g)+1/2O2(g)==CO2(g) ΔH=-283.0 kJ·mol-1;
③C(石墨)+O2(g)==CO2(g) ΔH=-393.5 kJ·mol-1。
根据盖斯定律:③×6-①×2-②×6得:
4Fe(s)+3O2(g)=2Fe2O3(s)的ΔH为-1641.0kJ·mol-1。

 高中必刷题系列答案
高中必刷题系列答案【题目】A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子。
微粒 | A | B | C | D | E | F | G |
原子核数 | 单核 | 单核 | 多核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A粒子的结构示意图是_________。
(2)用电子式表示D的形成过程: ________________________
(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为______>_______(用化学式表示)。
(4)D与G反应的化学方程式是_________________。
(5)C粒子是_________,F粒子是_________(用电子式表示)。
【题目】仔细分析下列表格中烃的排列规律,判断排列在第15位烃的分子式是( )
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | … |
C2H2 | C2H4 | C2H6 | C3H4 | C3H6 | C3H8 | C4H6 | C4H8 | C4H10 | … |
A. C6H14 B. C6H12 C. C7H12 D. C7H14