题目内容
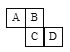
【题目】A,B,C,D,E,F,G为7种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下,其中:B的离子半径大于E的离子半径;D是由极性键构成的4原子分子;C与F可形成D和G分子。
微粒 | A | B | C | D | E | F | G |
原子核数 | 单核 | 单核 | 多核 | 多核 | 单核 | 多核 | 多核 |
电荷数 | 0 | 1+ | 1- | 0 | 2+ | 1+ | 0 |
(1)A粒子的结构示意图是_________。
(2)用电子式表示D的形成过程: ________________________
(3)比较B与E相应元素的最高价氧化物对应水化物的碱性强弱,为______>_______(用化学式表示)。
(4)D与G反应的化学方程式是_________________。
(5)C粒子是_________,F粒子是_________(用电子式表示)。
【答案】 ![]()
![]() NaOH Mg(OH)2 NH3 +H2O== NH3 .H2O OH-
NaOH Mg(OH)2 NH3 +H2O== NH3 .H2O OH- 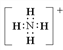
【解析】本题考查元素周期表中的“位构性”应用,以及化学用语的正确使用,(1)都是10电子微粒,A为单核,且电荷数为0,A为Ne,其原子结构示意图为:![]() ;(2)D是由极性键构成的4原子分子,电荷数为0,即D为NH3,NH3是共价化合物,
;(2)D是由极性键构成的4原子分子,电荷数为0,即D为NH3,NH3是共价化合物,![]() ;(3)B为单核的+1价阳离子,即B为Na+,对应元素是Na,其最高价氧化物对应水化物是NaOH,E是单核显+2价的阳离子,即E为Mg2+,对应元素是Mg,其最高价氧化物对应水化物是Mg(OH)2,金属性越强,其最高价氧化物对应水化物的碱性越强,金属性:Na>Mg,即碱性:NaOH>Mg(OH)2;(4)C为多核带有-1价阴离子,即C为OH-,F为多核的+1价阳离子,可能是H3O+,也可能是NH4+,C与F形成NH3和G,因此F为NH4+,NH4++OH-
;(3)B为单核的+1价阳离子,即B为Na+,对应元素是Na,其最高价氧化物对应水化物是NaOH,E是单核显+2价的阳离子,即E为Mg2+,对应元素是Mg,其最高价氧化物对应水化物是Mg(OH)2,金属性越强,其最高价氧化物对应水化物的碱性越强,金属性:Na>Mg,即碱性:NaOH>Mg(OH)2;(4)C为多核带有-1价阴离子,即C为OH-,F为多核的+1价阳离子,可能是H3O+,也可能是NH4+,C与F形成NH3和G,因此F为NH4+,NH4++OH-![]() NH3↑+H2O,G为H2O,因此D和G的反应是NH3+H2O=NH3·H2O;(5)根据问题(4)的分析,C为OH-,F为NH4+,其电子式为
NH3↑+H2O,G为H2O,因此D和G的反应是NH3+H2O=NH3·H2O;(5)根据问题(4)的分析,C为OH-,F为NH4+,其电子式为 。
。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案