题目内容
【题目】25℃时,pH简单计算。
(1)0.05mol/L的硫酸溶液的pH=________________;0,01mol/L的NaOH溶液的pH=________________。
(2)1mlpH=2的硫酸加水稀释至100ml,pH=___________。
(3)常温下,由水电离出的C(H+)=1×10-12mol/L,则,该溶液的可能pH=___________。
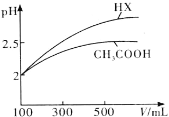
(4)体积均为100mL pH=2的CH3COOH与一元酸HX,加水稀释过程中pH与溶液体积的关系如图所示,则HX的电离平衡常数________(填“大于”、“小于”或“等于”)CH3COOH的电离平衡常数。
(5)常温下,常温下,pH=12的NaOH溶液与pH=1的HCl溶液按一定比例混合,所得溶液pH=2,则NaOH溶液与HCl溶液的体积比为_________________。
【答案】112412或2大于9:2
【解析】
(1)根据1个硫酸分子中有2个氢原子,可求出C(H+);根据Kw求出C(H+);
(2)1mL pH=2的H2SO4溶液加水稀释到100mL,c(H+)由0.01mol·L-1变为0.0001mol·L-1;
(3)常温下,由水电离出的C(H+)=1×10-12mol/L,如果是酸C(H+)=0.01mol/L,如果是碱C(OH-)=0.01mol/L;
(4)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸。
(5)依据酸碱反应实质为H++OH-=H2O,常温下溶液中c(H+)c(OH-)=10-14,混合后溶液显酸性,说明氢离子过量,结合定量关系计算混合溶液中过量的氢离子浓度为10-2mol·L-1,得到酸碱溶液的体积比。
(1)0.05mol·L-1硫酸溶液中,C(H+)═2c(SO42-)=0.1mol·L-1,则pH=-lgC(H+)═1;
0.01mol·L-1,氢氧化钠为强碱,则溶液中氢氧根离子浓度c(OH-)=10-2mol·L-1,常温下Kw=10-14,依据Kw=c(H+)c(OH-),C(H+)=10-14/10-2=10-12mol·L-1,则溶液pH=-lg10-12=12;
(2)1mL pH=2的H2SO4溶液加水稀释到100mL,溶液中氢离子浓度c(H+)由0.01mol·L-1变为0.0001mol·L-1,则稀释后溶液的pH=-lg0.0001=4;
(3)如果是酸:c(H+)==0.01mol·L-1,溶液的pH=-lg0.01=2;
如果是碱c(OH-)=0.01mol·L-1,c(H+)=1×10-14/C(OH-)mol·L-1=1×10-14/0.01mol·L-1=1×10-12mol·L-1,该氢氧化钠溶液的pH=-lg1×10-12=12;
(4)pH相等的酸中,加水稀释促进弱酸电离,稀释相同的倍数,pH变化大的为强酸,小的为弱酸,所以HX的酸性大于醋酸,则HX的电离平衡常数大于醋酸;
(5)pH=12的NaOH溶液中c(OH-)=10-2mol·L-1,pH=1的HCl溶液c(H+)=0.1mol·L-1;设氢氧化钠溶液体积为V(碱),酸溶液体积为V(酸),依据溶液混合后pH=2,氢离子过量,混合溶液中氢离子浓度计算为:c(H+)=(0.1V(酸)-0.01V(碱))/(V(酸)+V(碱))=0.01,解得V(碱):V(酸)=9:2。

 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案