题目内容
【题目】滴定是一种重要的定量实验方法:
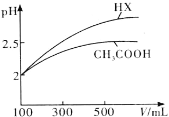
Ⅰ.酸碱中和滴定:常温下,用0.1000mol/L NaOH溶液分别滴定20.00mL 等浓度的盐酸和醋酸溶液,得到两条滴定曲线,如下图所示:
(1)滴定盐酸的曲线是图__________(填“1”或“2”)
(2)滴定前CH3COOH的电离度为__________
(3)达到B、D状态时,反应消耗的NaOH溶液的体积a__________b(填“>”“<”或“=”)
Ⅱ.氧化还原滴定原理与中和滴定原理相似,为了测定某NaHSO3固体的纯度,现用0.1000mol/L的酸性KMnO4溶液进行滴定,回答下列问题:
(1)准确量取一定体积的酸性KMnO4溶液需要使用的仪器是___________________。
(2)已知酸性KMnO4溶液的还原产物为MnSO4,写出此反应的离子方程式:_____
(3)若准确称取WgNaHSO3固体溶于水配成500mL溶液,取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。则滴定终点的现象为_______NaHSO3固体的纯度为_________。
(4)下列操作会导致测定结果偏低的是__________.
A 未用标准浓度的酸性KMnO4溶液润洗滴定管
B 滴定前锥形瓶未干燥
C 盛装酸性KMnO4溶液的滴定管,滴定前滴定管尖嘴部分有气泡, 滴定后无气泡
D 不小心将少量酸性KMnO4溶液滴在锥形瓶外
E 观察读数时,滴定前仰视,滴定后俯视
【答案】1 1% > 酸式滴定管 5HSO3-+2MnO4-+ H+=5SO42-+2Mn2++3H2O 溶液由无色变为紫红色,且半分钟不褪色 ![]() ×100% E
×100% E
【解析】
Ⅰ.(1)CH3COOH不完全电离,HCl完全电离,使CH3COOH溶液中c(H+)比同浓度的HCl溶液中c(H+)小,pH大;滴定盐酸的曲线是图1,故答案为:1;
(2)根据图1可知盐酸溶液的起始浓度为0.1mol/L,盐酸溶液和醋酸溶液是等浓度的,所以醋酸溶液起始浓度也为0.1mol/L,根据图2可知醋酸溶液的起始pH=3,溶液中c(H+)=10-3mol/L,电离度α=![]() ×100%=1%,故答案为:1%;
×100%=1%,故答案为:1%;
(3)达到B、D状态时,溶液为中性,NaCl不水解,CH3COONa水解使溶液呈碱性,为使CH3COONa溶液显中性,需要少加一部分NaOH,使溶液中留有一部分CH3COOH,所以反应消耗的NaOH溶液的体积a>b,故答案为:>;
Ⅱ.(1)高锰酸钾溶液具有强氧化性,能腐蚀碱式滴定管的橡皮管,所以选用酸式滴定管量取高锰酸钾溶液;故答案为:酸式滴定管;
(2)酸性KMnO4溶液的还原产物为MnSO4,+4价的硫被氧化为+6价,生成硫酸根离子,反应的离子方程式为:5HSO3-+2MnO4-+ H+=5SO42-+2Mn2++3H2O ,故答案为:5HSO3-+2MnO4-+ H+=5SO42-+2Mn2++3H2O ;
(3)KMnO4溶液呈紫色,与NaHSO3反应,紫色褪去,滴定终点的现象为:滴入最后一滴KMnO4溶液,紫色不褪去;故答案为:溶液由无色变为紫红色,且半分钟不褪色;
若准确称取WgNaHSO3固体溶于水配成500mL溶液,取25.00mL置于锥形瓶中,用KMnO4溶液滴定至终点,消耗KMnO4溶液VmL。
2MnO4 ~ 5HSO3-
0.1mol/L×V×10-3L n(HSO3-)
解得 n(HSO3-)=5/2×V×10-4mol,即25.00mL溶液中NaHSO3的物质的量为5/2×V×10-4mol,所以500mL溶液中NaHSO3的物质的量为5×V×10-3mol,NaHSO3固体的质量为5×V×10-3mol×104g/mol=5.2×V×10-1g,纯度为![]() ×100%=
×100%= ![]() ×100%,故答案为:
×100%,故答案为:![]() ×100%;
×100%;
(4)A.未用标准浓度的酸性KMnO4溶液润洗滴定管,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=c(标准)v(标准)/v(待测)分析,c(标准)偏大;
B.滴定前锥形瓶未干燥,待测液的物质的量不变,对V(标准)无影响,根据c(待测)=c(标准)v(标准)/v(待测)分析,c(标准)不变;
C.滴定前滴定管尖嘴部分有气泡,滴定后无气泡,造成V(标准)偏大,根据c(待测)=c(标准)v(标准)/v(待测)分析,c(标准)偏大;
D.不小心将少量酸性KMnO4溶液滴在锥形瓶外,造成V(标准)偏大,根据c(待测)=c(标准)v(标准)/v(待测)分析,c(标准)偏大;
E.观察读数时,滴定前仰视,滴定后俯视,造成V(标准)偏小,根据c(待测)=c(标准)v(标准)/v(待测)分析,c(标准)偏小;
综上所述,操作会导致测定结果偏低的是E,故选E。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】下表列出了①~⑨九种元素在周期表中的位置:
ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑧ | ||||
3 | ⑤ | ⑥ | ⑦ | ⑨ |
请按要求回答下列问题。
(1)元素④的名称是______
(2)元素⑦的原子结构示意图是____________。
(3)按气态氢化物的稳定性由弱到强的顺序排列,⑥④⑦的氢化物稳定性:________(写氢化物的化学式)。
(
(5)元素⑤的单质在氧气中燃烧所得产物中化学键的类型为_____________________
(6)用电子式表示①与⑨反应得到的化合物的形成过程_______________。
(7)两种均由①④⑤⑦四种元素组成的化合物,在水溶液中发生反应的离子反应方程式为________
(8)第三周期元素Na Mg Al S Cl 的简单离子半径由大到小的顺序是______(用离子符号表示)
(9)已知1g①的单质燃烧生成液态产物时放出142.9kJ的热量,写出表示该单质燃烧热的热化学方程式:____________
【题目】据题目提供的溶度积数据进行计算并回答下列问题:
(1)在Ca(NO3)2溶液中加入(NH4)2CO3溶液后过滤,若测得滤液中c(CO32-)=10-3mol·L-1,则Ca2+是否沉淀完全?________(填“是”或“否”)。[已知c(Ca2+)≤10-5mol·L-1时可视为沉淀完全,Ksp(CaCO3)=4.96×10-9]
(2)已知25℃时,Ksp[Mg(OH)2]=4.0×10-12;酸碱指示剂百里酚蓝变色的pH范围如下:
pH | <8.0 | 8.0~9.6 | >9.6 |
颜色 | 黄色 | 绿色 | 蓝色 |
25℃时,在Mg(OH)2饱和溶液中滴加2滴百里酚蓝指示剂,溶液的颜色为___________。
(3)向50 mL 0.018 mol·L-1的AgNO3溶液中加入50 mL 0.020 mol·L-1的盐酸,生成沉淀。已知该温度下AgCl的Ksp=1.0×10-10,忽略溶液的体积变化,请计算:
①完全沉淀后,溶液中c(Ag+)=__________ mol·L-1。
②完全沉淀后,溶液的pH=__________。
(4) 已知常温下Ksp[Fe(OH)3]=1×10-39,某CuSO4溶液中含有Fe3+,可以加入_________调节溶液的pH=___________使溶液中的c(Fe3+)=10-5 mol/L除去