题目内容
500℃条件下,在恒容密闭容器中,充入1molNO2存在如下平衡2NO2(g) N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
N2O4(g) ,平衡后,向容器内再充入1molNO2,下列说法正确的
| A.平衡向正反应方向移动 |
| B.平衡常数K增大 |
| C.NO2的转化率变小 |
| D.容器内气体颜色先变深后变浅,最后比原来还要浅 |
A
解析试题分析:A.当反应达到平衡后,增加反应物的浓度,化学平衡向正反应方向移动。正确。B.化学平衡常数只与温度有关,而与其它条件无关,所以K不变。错误。C.由于反应物只有一种,且正反应是气体体积减小的反应,所以增加反应物的浓度,平衡正向移动,这时该反应物的转化率增大。错误。D.增加反应物的浓度,化学平衡正向移动,使反应物的浓度减小,但由于该反应是在体积固定的密闭容器中进行的,对NO2来说,浓度要比原来大。故颜色比加入的瞬间小,但比原来颜色要深。错误。
考点:考查增加反应物的浓度对化学平衡移动、化学平衡常数、物质的转化率及浓度的影响的知识。

 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案下列表格中的各种情况,可以用下面的图象曲线表示的是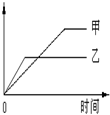
| | 反应 | 纵坐标 | 甲 | 乙 |
| A | 等质量钾、钠分别与足量水反应 | H 2质量 | 钠 | 钾 |
| B | 相同质量氨气,在同一容器中 2NH3 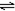 N2+3H2 ΔH >0 N2+3H2 ΔH >0 | 氨气的转化率 | 500℃ | 400℃ |
| C | 在体积可变的恒压容器中,体积比1:3的N2、H2,N2+3H2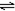 2NH3 2NH3 | 氨气的浓度 | 活性一般的催化剂 | 活性高的催化剂 |
| D | 2molSO2与lmolO2,在相同温度下2SO2(g)+O2(g)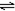 2SO3(g) 2SO3(g) | SO3物质的量 | 2个大气压 | 10个大气压 |
向四个体积相同的密闭容器中分别充人一定量的SO2和O2,开始反应是,按正反应速率由大到小的顺序排列正确的是
甲:在 500℃时,SO2和O2各 10 mol 反应
乙:在500℃时,用V2O5作催化剂,SO2和O2各10 mol反应
丙:在450℃时,8 mol SO2和5 mol O2反应
丁:在500℃时,8 mol SO2和5 mol O2反应
| A.乙、甲、丁、丙 | B.乙、申、丙、丁 |
| C.甲、乙、丙、丁 | D.丁、丙、乙、甲 |
反应2SO2+O2 2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为 ( )
2SO3经一段时间后,SO3的浓度增加了0.4 mol·L-1,在这段时间内用O2表示的反应速率为0.04 mol·L-1·s-1,则这段时间为 ( )
| A.0.1 s | B.2.5 s | C.5 s | D.10 s |
下列说法正确的是
| A.氨水加水稀释后,溶液中c(NH3·H2O) /c(NH4+)的值减小 |
| B.一定条件下,使用催化剂能加快反应速率并提高反应物的平衡转化率 |
| C.常温下,2NO(g)+O2(g)=2NO2(g)能够自发进行,则该反应的△H<0 |
| D.相同条件下,Na2CO3溶液的碱性强于C6H5ONa,说明C6H5OH的酸性强于H2CO3 |
某恒温密闭容器发生可逆反应:Z(?)+W(?) X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
X(g)+Y(?) ΔH,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中正确的是
| A.Z和W在该条件下至少有一个是为气态 |
| B.t1~t2时间段与t3时刻后,两时间段反应体系中气体的平均摩尔质量可能相等也可能不等 |
| C.若在该温度下此反应平衡常数表达式为K=c(X),则t1~t2时间段与t3时刻后的X浓度不相等 |
| D.若该反应只在某温度T以上自发进行,则该反应的平衡常数K随温度升高而减小 |
反应N2+3H2 2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
2NH3刚开始时,N2的浓度为3 mol/L,H2的浓度为5 mol/L,3 min后测得NH3浓度为0.6 mol/L,则此时间内,下列反应速率表示正确的是
| A.v(NH3)="0.2" mol/(L·s) | B.v(N2)="1.0" mol/(L·min) |
| C.v(H2)="1.67" mol/(L·min) | D.v(H2)="0.3" mol/(L·min) |
某实验小组以H2O2分解为例,研究浓度、催化剂对反应速率的影响。在常温下按照如下方案完成实验。实验②的反应物应为
| 实验编号 | 反应物 | 催化剂 |
| ① | 10 mL 2% H2O2溶液 | 无 |
| ② | | 无 |
| ③ | 10 mL 5% H2O2溶液 | MnO2固体 |
A.5 mL 2% H2O2溶液 B.10 mL 5% H2O2溶液
C.10 mL 2% H2O2溶液 D.5 mL 10% H2O2溶液
 2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法: