题目内容
5.下列有关实验装置进行的相应实验,能达到实验目的是( )| A. | 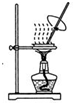 蒸发FeCl3溶液得氯化铁晶体 蒸发FeCl3溶液得氯化铁晶体 | |
| B. | 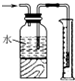 测量氯气的体积 测量氯气的体积 | |
| C. | 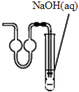 作为制取少量SO2的尾气吸收装置 作为制取少量SO2的尾气吸收装置 | |
| D. | 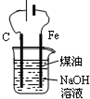 制备Fe(OH)2并能较长时间观察其颜色 制备Fe(OH)2并能较长时间观察其颜色 |
分析 A.氯化铁是强酸弱碱盐,铁离子水解生成稀盐酸,盐酸具有挥发性,且升高温度促进其挥发;
B.氯气能溶于水,不能采用排水法收集;
C.后缓冲装置的能防止倒吸;
D.用C作阳极、Fe作阴极电解NaOH溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,所以相当于电解水,得不到氢氧化亚铁.
解答 解:A.氯化铁是强酸弱碱盐,铁离子水解生成稀盐酸,盐酸具有挥发性,且升高温度促进其挥发,所以蒸干溶液时得到的固体是氢氧化铁而不是氯化铁,故A错误;
B.氯气能溶于水,1体积水能溶解2体积氯气,所以不能采用排水法收集,故B错误;
C.后缓冲装置的能防止倒吸,该装置有缓冲作用,能防止倒吸,故C正确;
D.用C作阳极、Fe作阴极电解NaOH溶液时,阳极上氢氧根离子放电、阴极上氢离子放电,所以相当于电解水,得不到氢氧化亚铁;应该用Fe作阳极、C作阴极电解氢氧化钠溶液,阳极上Fe失电子生成亚铁离子进入溶液,亚铁离子和氢氧根离子反应生成氢氧化亚铁沉淀,煤油能隔绝空气,故D错误;
故选C.
点评 本题考查化学实验方案评价,涉及气体收集、盐类水解、尾气处理、物质制备等知识点,明确实验原理及物质性质是解本题关键,注意从实验操作规范性及评价性进行分析解答,知道氢氧化亚铁的制备中要防止氢氧化亚铁被氧化,为易错点.

练习册系列答案
 初中暑期衔接系列答案
初中暑期衔接系列答案
相关题目
15.按一定的特点或规律对物质进行分类,给化学学习与研究带来很大的方便.下列各组物质中,符合“氧化物-酸-碱-盐”顺序排列的是( )
| A. | H2SO4 HCl Mg(OH)2 MgCl2 | B. | CO2 H2CO3 Na2CO3 Ca(HCO3)2 | ||
| C. | H2O HNO3 NaOH KNO3 | D. | SO3 NaHCO3 NaOH Na2SO4 |
16.进行蒸发操作时,下列操作正确的是( )
| A. | 使蒸发皿盛满滤液,用小火加热 | |
| B. | 等到蒸发皿中出现较多量固体时停止加热 | |
| C. | 待溶液蒸干后,再停止加热 | |
| D. | 将蒸发皿放在石棉网上,用酒精灯加热 |
10.在1000mL含有等物质的量的HBr和H2SO3溶液中通入0.01molCl2,有一半Br-变为Br2,原溶液中HBr和H2SO3的浓度都等于( )
| A. | 0.007 5 mol•L-1 | B. | 0.008 mol•L-1 | C. | 0.075 mol•L-1 | D. | 0.08 mol•L-1 |
17.下列说法正确的是( )
| A. | CO2分子的比例模型示意图: | |
| B. | HCN分子的结构式:H-C≡N | |
| C. | NaHCO3在水中的电离方程式:NaHCO3?Na++H++CO32- | |
| D. | 铝既能与盐酸反应又能与NaOH溶液反应,故铝是两性元素 |
14.设 NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 18g H2O所含的电子数目为9NA | |
| B. | 0.1mol/L Na2SO4溶液所含Na+数目为0.2NA | |
| C. | 标准状况下22.4 LO2所含的原子数目为NA | |
| D. | 1mol Na完全反应时所失去的电子数为NA |
