题目内容
13.甲醇来源丰富、价格低廉、运输贮存方便,是一种重要的化工原料,有着重要的用途和应用前景.(1)工业生产甲醇的常用方法是CO(g)+2H2(g)═CH3OH(g)△H=-90.8kJ•mol-1.
已知:2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1
H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJ•mol-1
①H2的燃烧热△H=-285.8kJ•mol-1.
②CH3OH(g)+O2(g)═CO(g)+2H2O(g)的反应热△H=-392.8kJ/mol.
(2)工业上利用甲醇制备氢气常用方法之一是甲醇蒸气重整法.该法中的一个主要反应为CH3OH(g)═CO(g)+2H2(g),此反应能自发进行的原因是反应是熵增加的反应.
分析 (1)①燃烧热是1mo可燃物完全燃烧生成稳定氧化物放出的热量,根据盖斯定律及已知热化学方程式得出氢气燃烧热的热化学方程式;
②依据盖斯定律和热化学方程式计算得到;
(2)反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应.
解答 解:(1)①2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1①
H2(g)+1/2O2(g)═H2O(g)△H=-241.8kJ•mol-1②,
根据盖斯定律①×$\frac{1}{2}$+②可得:氢气的燃烧热的热化学方程式为:H2(g)+$\frac{1}{2}$O2(g)=H2O (l)△H=-285.8kJ/mol,
所以氢气的燃烧热为:△H═-285.8KJ/mol,
故答案为:-285.8;
②CO(g)+2H2(g)?CH3OH(g)△H=-90.8kJ/mol②,
H2(g)+$\frac{1}{2}$O2(g)=H2O(g)△H=-241.8kJ/mol②,
根据盖斯定律②×2-①得到:CH3OH(g)+O2(g)?CO(g)+2H2O(g)△H=-392.8 kJ/mol,
故答案为:-392.8 kJ/mol;
(2))反应为CH3OH(g)?CO(g)+2H2(g),此反应能自发进行的原因是△H-T△S<0,反应是熵增加的反应,
故答案为:反应是熵增加的反应.
点评 本题考查了反应热的计算、盖斯定律的应用,题目难度中等,注意掌握热化学方程式的书写原则,明确盖斯定律在反应热计算中的应用,试题培养了学生的分析能力及化学计算能力.

练习册系列答案
相关题目
3.N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是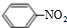 .
.
(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②如表为反应在T1温度下的部分实验数据:
则500s内N2O5的分解速率为0.00296 mol•L-1•s-1.
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1(填>、<或=).
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2.

写出石墨Ⅰ电极上发生反应的电极反应式H2+CO32--2e-═H2O+CO2,N2O5在电解池的阳极区生成(填“阳极”或“阴极”).
(1)N2O5与苯发生硝化反应生成的硝基苯的结构简式是
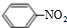 .
.(2)一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)?4NO2(g)+O2(g);△H>0
①反应达到平衡后,若再通入一定量氮气,则N2O5的转化率将不变(填“增大”、“减小”、“不变”).
②如表为反应在T1温度下的部分实验数据:
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
③在T2温度下,反应1000s时测得NO2的浓度为4.98mol•L-1,则T2<T1(填>、<或=).
(3)现以H2、O2、熔融Na2CO3组成的燃料电池采用电解法制备N2O5,装置如图所示,其中Y为CO2.

写出石墨Ⅰ电极上发生反应的电极反应式H2+CO32--2e-═H2O+CO2,N2O5在电解池的阳极区生成(填“阳极”或“阴极”).
1.将下列物质按酸、碱、盐、氧化物分类排列,正确的是( )
| A. | 硫酸,纯碱,硫酸铜,氧气 | B. | 硫酸,烧碱,硝酸钡,干冰 | ||
| C. | 碳酸,乙醇,醋酸钠,水 | D. | 磷酸,熟石灰,氢氧化钾,氧化钠 |
8.下列物质中,与氯气、盐酸都能发生反应且生成不同氯化物的是( )
| A. | Zn | B. | Al | C. | Cu | D. | Fe |
18.有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
| A. | 0.1mol/L | B. | 0.15mol/L | C. | 0.2mol/L | D. | 0.25mol/L |
5.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 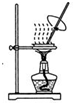 蒸发FeCl3溶液得氯化铁晶体 蒸发FeCl3溶液得氯化铁晶体 | |
| B. | 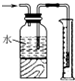 测量氯气的体积 测量氯气的体积 | |
| C. | 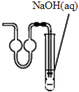 作为制取少量SO2的尾气吸收装置 作为制取少量SO2的尾气吸收装置 | |
| D. | 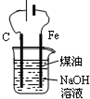 制备Fe(OH)2并能较长时间观察其颜色 制备Fe(OH)2并能较长时间观察其颜色 |
2.下列有机物的结构简式书写正确的是( )
| A. | 3-甲基丁醛 (CH3)2CHCH2COH | B. | TNT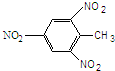 | ||
| C. | 硬脂酸甘油酯 | D. | 乙酸甲酯 CH3OOCCH3 |
3.常温下,将0.1mol•L-1的醋酸溶液加水稀释至原来体积的10倍,下列有关叙述正确的是( )
| A. | CH3COOH的电离平衡常数增大为原来的10倍 | |
| B. | CH3COO-与CH3COOH的浓度之比增大为原来的10倍 | |
| C. | CH3COOH与CH3COO-的浓度之和减小为原来的$\frac{1}{10}$ | |
| D. | CH3COO-与H+的浓度之积减小为原来的$\frac{1}{10}$ |