题目内容
17.下列说法正确的是( )| A. | CO2分子的比例模型示意图: | |
| B. | HCN分子的结构式:H-C≡N | |
| C. | NaHCO3在水中的电离方程式:NaHCO3?Na++H++CO32- | |
| D. | 铝既能与盐酸反应又能与NaOH溶液反应,故铝是两性元素 |
分析 A.二氧化碳为直线型结构;
B.书写结构简式时注意C≡N三键不能省略;
C.HCO3-在水中部分电离;
D.铝属于两性物质.
解答 解:A.二氧化碳为直线型结构,其正确的比例模型为 ,故A错误;
,故A错误;
B.HCN分子中存在C-H和C≡N,其结构式为H-C≡N,故B正确;
C.HCO3-在水中部分电离,所以NaHCO3在水中的电离方程式为NaHCO3=Na++HCO3-,故C错误;
D.铝既能与酸反应,又能与强碱溶液反应,属于两性物质,但是不属于两性元素,故D错误.
故选B.
点评 本题考查了化学用语的判断,属于基础知识的考查,题目难度中等,注意掌握常见有机物的表示方法,试题考查了学生规范答题的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
7.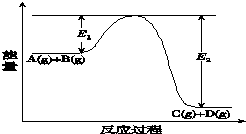 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
①图中E1代表的意义是反应物的活化能.
该反应是放热反应(填“吸热”或“放热”).反应热△H的表达式为E1-E2 .
②当反应达到平衡时,升高温度,A的转化率减小(填“增大”“减小”或“不变”).
(2)800℃时,在2L密闭容器内充入0.50mol NO和0.25mol O2,发生如下反应:2NO(g)+O2(g)═2NO2(g)△H<0.体系中,n(NO)随时间的变化如下表:
①能说明该反应已达到平衡状态的是BCD.
A.v(NO2)正=v(O2)逆 B.容器内压强保持不变
C.v(NO)逆=2v(O2)正D.容器内气体颜色不变
②能使该反应的反应速率增大,且平衡向正反应方向移动的措施是BC.
A.适当升高温度 B.缩小反应容器的体积C.增大O2的浓度 D.选择高效催化剂.
 反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.
反应A(g)+B(g)?C(g)+D(g)过程中的能量变化如图所示(E1>0,E2>0),回答下列问题.①图中E1代表的意义是反应物的活化能.
该反应是放热反应(填“吸热”或“放热”).反应热△H的表达式为E1-E2 .
②当反应达到平衡时,升高温度,A的转化率减小(填“增大”“减小”或“不变”).
(2)800℃时,在2L密闭容器内充入0.50mol NO和0.25mol O2,发生如下反应:2NO(g)+O2(g)═2NO2(g)△H<0.体系中,n(NO)随时间的变化如下表:
| t/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.50 | 0.35 | 0.28 | 0.25 | 0.25 | 0.25 |
A.v(NO2)正=v(O2)逆 B.容器内压强保持不变
C.v(NO)逆=2v(O2)正D.容器内气体颜色不变
②能使该反应的反应速率增大,且平衡向正反应方向移动的措施是BC.
A.适当升高温度 B.缩小反应容器的体积C.增大O2的浓度 D.选择高效催化剂.
8.下列物质中,与氯气、盐酸都能发生反应且生成不同氯化物的是( )
| A. | Zn | B. | Al | C. | Cu | D. | Fe |
5.下列有关实验装置进行的相应实验,能达到实验目的是( )
| A. | 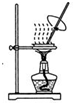 蒸发FeCl3溶液得氯化铁晶体 蒸发FeCl3溶液得氯化铁晶体 | |
| B. | 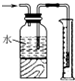 测量氯气的体积 测量氯气的体积 | |
| C. | 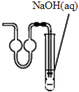 作为制取少量SO2的尾气吸收装置 作为制取少量SO2的尾气吸收装置 | |
| D. | 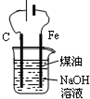 制备Fe(OH)2并能较长时间观察其颜色 制备Fe(OH)2并能较长时间观察其颜色 |
12.下列关于化学基本概念和基本理论的几点认识中正确的是( )
| A. | 胶体区别于其它分散系的本质特征是具有丁达尔现象 | |
| B. | 碱性氧化物一定是金属氧化物、金属氧化物不一定是碱性氧化物 | |
| C. | 能在水溶液中电离出氢离子的化合物一定是酸 | |
| D. | 置换反应和分解反应都属于氧化还原反应 |
2.下列有机物的结构简式书写正确的是( )
| A. | 3-甲基丁醛 (CH3)2CHCH2COH | B. | TNT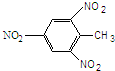 | ||
| C. | 硬脂酸甘油酯 | D. | 乙酸甲酯 CH3OOCCH3 |
9.下列物质既能通过单质间化合反应制取,也能通过单质与盐酸反应制取的是( )
| A. | CuCl2 | B. | FeCl2 | C. | FeCl3 | D. | ZnCl2 |
6.在某溶液中酚酞呈粉红色.下列离子在该溶液中不能大量存在的是( )
| A. | K+ | B. | Na+ | C. | Ba2+ | D. | Cu2+ |
