题目内容
【题目】CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq) ![]() H3CuCl4(aq)。
H3CuCl4(aq)。
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl-+2H2O=2CuCl43-+SO42-+4H+
CuCl43-(aq)![]() CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)
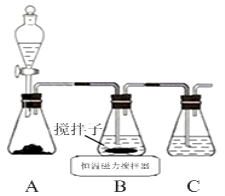
①装置C的作用是 。
②装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。
![]()
操作ⅱ的主要目的是 ;操作ⅳ中宜选用的试剂是 。
③实验室保存新制CuCl晶体的方法是 。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案: 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
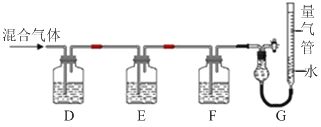
已知:i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
D、F洗气瓶中宜盛放的试剂分别是 、 。
②写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
【答案】(1)① 吸收SO2尾气 ② 促进CuCl固体析出、防止CuCl被氧化 ;水、稀盐酸、乙醇
③ 避光、密封 ④ 将固体溶于浓盐酸后过滤,取滤液加入大量水,过滤,洗涤,干燥
(2)① NaOH溶液(或“KOH溶液”“Ba(OH)2溶液”等其他合理答案) CuCl的盐酸溶液
② 2S2O42-+3O2+4OH- == 4SO42-+2H2O
【解析】
试题分析:(1)①A装置制备二氧化硫,B中盛放氯化铜溶液,与二氧化硫反应得到CuCl,C装置盛放氢氧化钠溶液,吸收未反应的二氧化硫尾气,防止污染空气。
②操作ⅱ倒入溶有二氧化硫的溶液,有利于CuCl析出,二氧化硫具有还原性,可以防止CuCl被氧化;CuCl难溶于水、稀盐酸和乙醇,可以用水、稀盐酸或乙醇洗涤,减小因溶解导致的损失。
③由于CuCl见光分解、露置于潮湿空气中易被氧化,应避光、密封保存。
④提纯某混有铜粉的CuCl晶体实验方案是将固体溶于浓盐酸后过滤,取滤液加入大量的水稀释,过滤、洗涤、干燥得到CuCl。
(2)①氢氧化钾会吸收二氧化碳,盐酸挥发出的HCl会影响氧气的吸收、二氧化碳的吸收,所以D中盛放氢氧化钠溶液吸收二氧化碳,E中盛放保险粉(Na2S2O4)和KOH的混合溶液吸收氧气,F中盛放CuCl的盐酸溶液吸收CO,G测定氮气的体积。
②Na2S2O4在碱性条件下吸收氧气,发生氧化还原反应生成硫酸钠与水,反应离子方程式为:2S2O42-+3O2 +4OH-==4SO42-+2H2O。