题目内容
18.如图为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器.试根据题目要求,回答下列问题: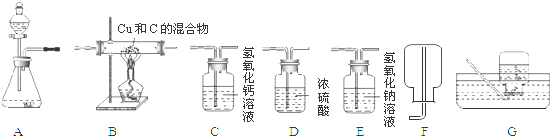
(1)某同学以锌粒和稀盐酸为原料在实验室制备、收集纯净干燥的氢气,选择仪器连接装置后,检查装置的气密性.
①所选装置的连接顺序为AEDF.
②若要验证氢气的可燃性,在点燃氢气之前一定要检验氢气的纯度.
③写出该同学制备氢气发生反应的化学方程式Zn+2HCl═ZnCl2+H2↑.
(2)若以H2O2溶液和MnO2在实验室中制备干燥的氧气,并用来测定B装置中盛有的Cu和C混合物中Cu的含量,取a g混合物样品放入装置B的硬质玻璃管中,所选仪器连接顺序为:A-D-B-C,试回答下列问题:
①仪器D的作用是干燥氧气.
②仪器B中的现象是红色的固体变黑.
③若通入足量氧气充分反应后,测得B装置中硬质玻璃管内固体的质量在反应前后无变化,则原混合物中Cu的质量是$\frac{4a}{5}$g.(计算结果可为分数形式)
④欲用化学方法证明硬质玻璃管内的固体在通入氧气后完全发生了反应,请设计实验方案,并简述操作步骤、现象和结论取玻璃管内固体加入稀硫酸,若固体全都溶解得到蓝色溶液,则固体在通入氧气后完全发生了反应.
分析 (1)①要制取纯净干燥的氢气,应依据反应物状态和反应条件选择发生装置、依据氯化氢、水的性质选择除杂装置,依据氢气的性质选择收集装置;
②可燃性气体点燃之前都应检验纯度,防止发生爆炸;
③锌与盐酸反应生成氯化锌和氢气;
(2)①浓硫酸具有吸水性;
②B中发生的反应为铜与氧气反应生成氧化铜,碳与氧气反应生成二氧化碳;
③依据通入足量氧气充分反应后,测得B装置中硬质玻璃管内固体的质量在反应前后无变化,可知B中反应后剩余固体为氧化铜,依据铜原子守恒计算铜的质量;
④铜与稀硫酸不反应,氧化铜与稀硫酸反应生成蓝色的硫酸铜溶液,据此解答.
解答 解:(1)①锌粒和稀盐酸生成氢气,选择发生装置为A,氯化氢易挥发,制取的氢气中含有氯化氢,和水,先后通过F用氢氧化钠溶液除去氯化氢气体,通过D用浓硫酸吸收水分,氢气密度小于空气,应选择向下排空气法收集,所以正确连接顺序为:AEDF;
故答案为:A E D F;
②为防止点燃氢气发生爆炸,所以应先检验氢气的纯度;
故答案为:检验氢气的纯度;
③锌与盐酸反应生成氯化锌和氢气,方程式为:Zn+2HCl═ZnCl2+H2↑;
Zn+2HCl═ZnCl2+H2↑;
(2)①浓硫酸具有吸水性,用来干燥氧气;
故答案为:干燥氧气;
②B中发生的反应为铜与氧气反应生成氧化铜,碳与氧气反应生成二氧化碳,所以看到现象为:红色的固体变黑;
故答案为:红色的固体变黑;
③依据通入足量氧气充分反应后,测得B装置中硬质玻璃管内固体的质量在反应前后无变化可知B中反应后剩余固体为氧化铜,依据铜原子守恒,铜元素的质量为a×$\frac{64}{80}$=$\frac{4a}{5}$;
故答案为:$\frac{4a}{5}$;
④铜与稀硫酸不反应,氧化铜与稀硫酸反应生成蓝色的硫酸铜溶液,欲用化学方法证明硬质玻璃管内的固体在通入氧气后完全发生了反应,可以采取方法为:取玻璃管内固体加入稀硫酸,若固体全都溶解得到蓝色溶液,则固体在通入氧气后完全发生了反应;
故答案为:取玻璃管内固体加入稀硫酸,若固体全都溶解得到蓝色溶液,则固体在通入氧气后完全发生了反应.
点评 本题考查了气体的制备实验,明确氢气、氧气的制备原理是解题关键,注意发生装置的选择应依据反应物的状态和条件选择,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | 德国化学家维勒用氰酸铵合成了尿素,打破了有机物与无机物的界限 | |
| B. | 根据核磁共振谱的分析能得到有机物的相对分子质量 | |
| C. | 分析红外光谱图可以初步判断有机物中具有哪些基团 | |
| D. | 同位素示踪法可以用来确定有机反应中化学键的断裂位置 |
| A. | 可溶性铁盐或铝盐可用于水的净化 | |
| B. | 电解MgCl2溶液可制金属镁 | |
| C. | 应用盖斯定律,可计算某些难以直接测量的反应焓变 | |
| D. | 航天飞机上的陶瓷防护片属于新型无机非金属材料 |
| A. | 滤液中一定有Zn(NO3)2 | B. | 滤渣中一定有Cu | ||
| C. | 滤液中一定没有AgNO3 | D. | 滤渣中一定有Ag |
| A. | 三种元素可组成CAB2和CAB3型化合物 | |
| B. | 离子半径:A3->B2->C+ | |
| C. | 氢化物稳定性:AH3>H2B | |
| D. | B的某种单质可用于杀菌消毒 |
①使用明矾可软化硬水;
②硫酸钡难溶于水和酸,可做X光透视肠胃的药剂;
③铁制品在干燥的空气中容易生锈;
④医疗中消毒用的酒精是75%的乙醇溶液;
⑤棉花、蚕丝、人造羊毛的主要成分都是纤维素;
⑥福尔马林是混合物,可用来制作生物标本.
| A. | ①②③ | B. | ②③⑥ | C. | ①③⑤ | D. | ②④⑥ |
| A. | 霾是一种分散系,分散质是固体 | |
| B. | 雾是一种分散系,分散剂是液体 | |
| C. | 减少汽车尾气的排放可以减少雾霾天气的形成 | |
| D. | 减少生产生活中产生的扬尘可以减少雾霾天气的形成 |
| A. | 葡萄糖注射液能产生丁达尔效应 | |
| B. | 高纯度的硅单质广泛用于制作光导纤维 | |
| C. | 二氧化硫的大量排放是造成光化学烟雾的主要原因 | |
| D. | 汽车的排气管上装有“催化转化器”,使有毒的CO和NO反应生成N2和CO2 |