题目内容
5.下列说法正确的是( )①${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H为三种不同的核素
②${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H互为同位素
③水与重水互为同素异形体
④最外层有2个电子的原子都是金属原子
⑤硒元素位于元素周期表的第6纵行
⑥互为同位素的原子性质相同
⑦非金属元素呈现的最高化合价不超过该元素原子的最外层电子数
⑧0.03mol铜溶于硝酸产生氮的氧化物(NO、NO2、N2O4)气体共 0.05mol.
该混合气体的相对分子质量可能是60.
| A. | ①②⑦⑧ | B. | ①②③⑥ | C. | ①②⑥⑦ | D. | ①②⑦ |
分析 ${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H均是氢元素的不同种元素,属于不同的核素,互称为同位素,据此解答①②⑥;
同素异形体为同种元素的不同种单质;
依据元素周期律的知识解答④⑤⑦;
依据平均相对分子质量定义计算⑧.
解答 解:①${\;}_{1}^{1}$H、${\;}_{1}^{2}$H、${\;}_{1}^{3}$H均是氢元素的不同种元素,属于不同的核素,故正确;
②同种元素的不同种原子互称同位素,故正确;
③水与重水均是化合物,不是单质,故错误;
④He最外层2个电子,为非金属元素,故错误;
⑤硒元素为VIA族元素,处于第16纵行,故错误;
⑥互为同位素的原子化学性质几乎相同,物理性质不同,故错误;
⑦非金属元素呈现的最高化合价为其所在的族序数,不超过最外层电子数,故正确;
⑧假设一种情况为混合气体中没有N2O4时,设NO的物质的量为x,则NO2的物质的量为0.05mol-x,根据电子得失守恒,铜失去的电子数等于NO3-得到的电子数,所以有0.03mol×2=3x+(0.05mol-x)×1,得:x=0.005mol,NO2的物质的量为0.05mol-0.005mol=0.045mol,所以混合气体的平均相对分子质量为$\frac{30×0.005+46×0.045}{0.05+0.045}$=44.4;
同理,假设另一种情况为混合体中没有NO时,设N2O4、NO2物质的量分别为m,n,m+n=0.05mol,2m+n=0.06mol,联立解得m=0.01mol,n=0.04mol,所以混合气体的平均相对分子质量为M(NO2、N2O4)=46×$\frac{4}{5}$+92×$\frac{1}{5}$=55.2.
所以该混合气体的平均相对分子质量应在44.4~55.2之间,故错误,正确的是①②⑦;故选D.
点评 本题主要考查的是同位素和核素的概念、元素周期律的应用、氧化还原反应原理等,综合性较强,难度较大.

 :则A的同分异构体中带苯环的化合物共有( )
:则A的同分异构体中带苯环的化合物共有( )| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |

| A. | 该药物可以用有机溶剂萃取 | |
| B. | 该有机物可与NaOH和NaHCO3发生反应 | |
| C. | 1mol该有机物可以与5mol Br2发生反应 | |
| D. | 该有机物分子中,可能有16个碳原子共平面 |
| 混合物 | 试剂 | 分离方法 | |
| A | 苯(苯酚) | 溴水 | 过滤 |
| B | 酒精(水) | 生石灰 | 蒸馏 |
| C | 苯(甲苯) | 酸性KMnO4溶液 | 分液 |
| D | 乙烷(乙烯) | Br2的CCl4溶液 | 洗气 |
| A. | A | B. | B | C. | C D.D |
| 选项 | 叙述I | 叙述II |
| A | 晶体硅熔点高硬度大 | 可用于制作半导体材料 |
| B | BaSO4难溶于酸 | 用硫酸和BaCl2溶液检验SO42- |
| C | NH3极易溶于水 | NH3可用于设计喷泉实验 |
| D | NaOH可以与SiO2反应 | 用NaOH溶液雕刻工艺玻璃上的纹饰 |
| A. | A | B. | B | C. | C | D. | D |
 某无色稀溶液X中,可能含有下表所列离子中的某几种.
某无色稀溶液X中,可能含有下表所列离子中的某几种.| 阴离子 | CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 | Al3+、Fe3+、Mg2+、NH4+、Na+ |
(1)若Y是盐酸,则X中一定含有的离子是SiO32-、AlO2-、CO32-、Na+,bc段发生反应的离子方程式为Al(OH)3+3H+═Al3++3H2O
(2)若Y是NaOH溶液,则X中一定含有的阴离子是Cl-,假设X溶液只含这几种离子,则溶液中各离子的物质的量之比为n(Al3+):n(Mg2+):n(NH4+):n(Cl-)=2:1:3:11,ab段发生反应的离子方程式为NH4++OH-═NH3•H2O.
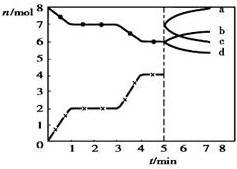
| A. | 1~3min时,v(CO)=v(CO2) | |
| B. | 当容器内的压强不变时,该反应一定达到平衡状态,且$\frac{P(平衡)}{P(开始)}<1$ | |
| C. | 若3min时温度由T1升高到T2,则Q>O,且$\frac{K({T}_{2})}{K({T}_{1})}$=4.7 | |
| D. | 5min时再充入一定量的CO,c、b曲线分别表示n(CO)、n(CO2)的变化 |
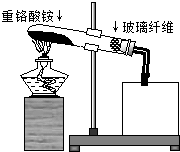 氮及其化合物在化学实验中有广泛应用:
氮及其化合物在化学实验中有广泛应用: