题目内容
月球表面土壤里的—种非常有用的资源——可控核聚变的原料,关于的叙述正确的是
| A.3He和4He是同种原子 |
| B.3He和4He互为同位素 |
| C.核聚变时,原子核发生了变化,发生了化学反应 |
| D.在3He中存在:质子数=中子数=核外电子数 |
B
解析试题分析:A、3He和4He的质子数相同,都是2,但中子数不同。由于质子数+中子数=质量数,所以中子数分别是3-2=1、4-2=2,因此二者是不同的核素,属于不同种原子,A不正确;B、3He和4He的质子数相同,而中子数不同,因此二者互为同位素,B正确;C、核聚变时,原子核发生了变化,但没有生成新的物质,属于物理变化,C不正确;D、在3He中存在:质子数=核外电子数=2,而中子数是1,D不正确,答案选B。
考点:考查原子组成、同位素判断以及组成原子的几种微粒之间数量关系的计算

练习册系列答案
相关题目
根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是 ( )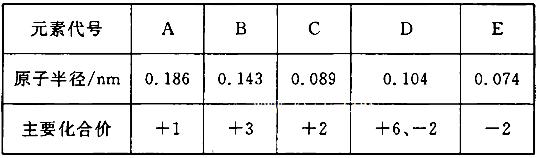
| A.E2-与B3+的核外电子数不可能相等 |
| B.离子半径大小A+<E2- |
| C.最高价氧化物对应水化物的碱性A<C |
| D.氢化物的稳定性H2D>H2E |
下列有关钛原子(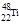 )的说法正确的是:
)的说法正确的是:
| A.质子数为48 | B.中子数为48 | C.质量数为22 | D.原子序数为22 |
下列说法正确的是
| A.电解饱和食盐水时,溶液中的OH-向阴极移动 |
| B.需要加热才能发生的反应不一定是吸热反应 |
| C.短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
Y元素最高正价与负价的绝对值之差为4,Y元素与M元素可形成离子化合物,该物质能溶于水并在水中电离出电子层结构相同的离子,该化合物是
| A.硫化钾 | B.硫化钠 | C.氯化钠 | D.氧化铝 |
由短周期元素和长周期元素共同组成的族可能是
| A.主族 | B.副族 | C.Ⅷ族 | D.Ⅶ族 |
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A.原子半径A>B>C>D |
| B.原子序数a>b>c>d |
| C.离子半径C3->D->B+>A2+ |
| D.单质的还原性A>B>D>C |
依据元素周期表及元素周期律,下列推断中正确的是( )
| A.同一周期元素的原子,半径越小越容易失去电子 |
| B.ⅠA族元素的金属性比ⅡA族元素的金属性强 |
| C.向氢硫酸溶液中滴入氯水有单质硫生成,可以验证硫元素的非金属性比氯元素弱 |
| D.主族元素的最高正化合价等于该元素原子的最外层电子数 |