题目内容
根据下表(部分短周期元素的原子半径及主要化合价)信息,下列叙述正确的是 ( )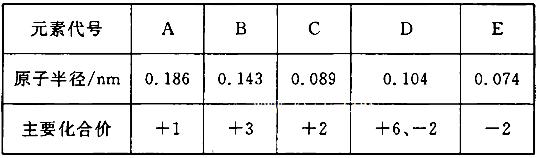
| A.E2-与B3+的核外电子数不可能相等 |
| B.离子半径大小A+<E2- |
| C.最高价氧化物对应水化物的碱性A<C |
| D.氢化物的稳定性H2D>H2E |
B
解析试题分析: 由表中数据可知A为钠,B为铝,C为铍,D为硫,E为氧。A. E2-与B3+的核外电子数都是10,相等,错误。 B.离子半径大小A+<E2-,正确。 C.钠比铝活泼,故最高价氧化物对应水化物的碱性C<A,错误。 D.元素的非金属性越强其对应氢化物的稳定性越稳定,应该是H2E>H2D,错误。
考点:本题考查原子的结构与性质的关系。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案简单原子的原子结构可用下图形象地表示: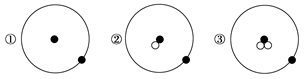
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是
a.①②③互为同位素
b.①②③由同种元素构成
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
| A.a、b、f | B.b、c、d | C.a、d、e | D.a、e、f |
月球表面土壤里的—种非常有用的资源——可控核聚变的原料,关于的叙述正确的是
| A.3He和4He是同种原子 |
| B.3He和4He互为同位素 |
| C.核聚变时,原子核发生了变化,发生了化学反应 |
| D.在3He中存在:质子数=中子数=核外电子数 |
He可以作为核聚变材料,科学家已经探明月球上有大量的3He存在,以下关于3He的说法正确的是( )
①比4He少一个电子
②比4He少一个质子
③与4He互为同素异形体
④3He的质量数为3,所以He元素的相对原子质量为3
⑤体积相同、密度相同的3He与HD具有相同的中子数
⑥是4He的同位素
| A.①③ | B.③⑤ | C.④⑥ | D.⑤⑥ |
元素周期表和元素周期律可以指导人们进行规律性的推测和判断。下列说法不合理的是( )
| A.若X+和Y2-的核外电子层结构相同,则原子序数:X>Y |
| B.由水溶液的酸性:HCl>H2S,可推断元素的非金属性:Cl>S |
| C.硅、锗都位于金属与非金属的交界处,都可以作半导体材料 |
| D.Cs和Ba分别位于第六周期ⅠA和ⅡA族,则碱性:CsOH>Ba(OH)2 |
某元素X的原子的核电荷数小于18,其原子的电子层数为n,最外层电子数为2n+1,原子核内质子数为2n2-1。下列有关X的说法中不正确的是( )。
| A.X能形成化学式为X(OH)3的碱 |
| B.X能与某些金属元素形成化合物 |
| C.X原子的最外层电子数和核电荷数肯定为奇数 |
| D.X可能形成化学式为KXO3的盐 |
短周期元素甲、乙、丙、丁的原子序数依次增大。甲的最高价氧化物与乙的气态氢化物同时通入水中,得到的生成物既可与酸反应又可与碱反应。丙位于第ⅠA族,丁原子的核外电子总数是其最外层电子数的3倍,则 ( )。
| A.气态氢化物的稳定性:乙<丁 |
| B.原子半径:甲<乙 |
| C.丙的两种氧化物都是离子化合物 |
| D.甲、乙、丁的最高价氧化物对应的水化物酸性依次增强 |