题目内容
下列说法正确的是
| A.电解饱和食盐水时,溶液中的OH-向阴极移动 |
| B.需要加热才能发生的反应不一定是吸热反应 |
| C.短周期元素形成离子后,最外层都能达到8(或2)电子稳定结构 |
| D.金属单质Na、Mg、Fe在一定条件下与水反应都生成H2和相应的碱 |
B
解析试题分析:电解饱和食盐水时溶液中的OH-向阳极移动;H+核外没有电子层;Fe与水反应时生成Fe3O4.
考点:化学原理。

练习册系列答案
相关题目
简单原子的原子结构可用下图形象地表示: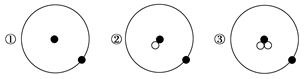
其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是
a.①②③互为同位素
b.①②③由同种元素构成
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
| A.a、b、f | B.b、c、d | C.a、d、e | D.a、e、f |
下列有关元素的性质及其递变规律正确的是
| A.Ⅰ A族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第二周期元素从左到右,正价从+1递增到+7 |
| C.同主族元素的简单阴离子还原性越强,水解程度越大 |
| D.同周期金属元素的化合价越高,其原子失电子能力越强 |
月球表面土壤里的—种非常有用的资源——可控核聚变的原料,关于的叙述正确的是
| A.3He和4He是同种原子 |
| B.3He和4He互为同位素 |
| C.核聚变时,原子核发生了变化,发生了化学反应 |
| D.在3He中存在:质子数=中子数=核外电子数 |
短周期元素W、X、Y、Z的原子序数依次增大,W、X原子的最外电子层电子数之比为4∶3,Z原子比X原子的核外电子数多4。下列说法正确的是
| A.吸引电子能力的大小顺序一定为Z>Y>W |
| B.原子半径的大小顺序一定为X>Y>Z>W |
| C.Y、Z形成的分子的空间构型可能是正四面体 |
| D.原子核外未成对电子数可能是Z>Y>X>W |
PASS是新一代高效净水剂,它由X、Y、Z、W、R五种短周期元素组成,五种元素原子序数依次增大。X原子是所有原子中半径最小的,Y、R同主族,Z、W、R同周期,Y原子的最外层电子数是次外层的3倍,Z是常见的金属,电子层数等于主族序数,W单质是人类将太阳能转变为电能的常用材料。下列说法正确的是
| A.Z与Y形成的化合物可作为耐高温材料 |
| B.WY2能与碱反应,但不能与任何酸反应 |
| C.原子半径按X、Y、Z、R、W的顺序依次增大 |
| D.熔沸点:X2R>X2Y |
几种短周期元素的原子半径及主要化合价如下表:
| 元素代号 | X | Y | Z | R | W |
| 原子半径/pm | 160 | 143 | 89 | 70 | 66 |
| 主要化合价 | +2 | +3 | +2 | +5、-3 | -2 |
下列叙述正确的是
A.X、Z元素的金属性:X < Z
B.气态氢化物的稳定性:R > W
C.Y的最高价氧化物既能溶于H2SO4又能溶于NaOH
D.一定条件下,R单质与常见的W单质能直接生成RW2
短周期主族元素X、Y、A、B、C在元素周期表的位置如图所示,A是电负性最大的元素,则下列说法不正确的是
| X | | | A |
| Y | | C | B |
A.原子半径由小到大的顺序为:A<B<C<Y
B.A、B的氢化物的沸点由低到高的顺序为:HA<HB
C.X、Y最高价氧化物对应的水化物的酸性由弱到强的顺序为:H2YO3<H2XO3
D.B、C简单离子的还原性由弱到强的顺序为:B-<C2-
下列说法中正确的是( )。
| A.6.8 g熔融KHSO4与3.9 g熔融Na2O2中阴离子数目相同 |
B.某金属阳离子的结构示意图为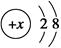 ,其与Cl-形成的强电解质都是离子化合物 ,其与Cl-形成的强电解质都是离子化合物 |
C.二硫化碳是直线形非极性分子,其电子式为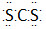 |
| D.中子数为18的氯原子可表示为18Cl |