��Ŀ����
����Ŀ��������������{[CH3CH(OH)COO]2Fe��3H2O}(��Է���������288)����������FeCO3��Ӧ�Ƶã���������ˮ�������������Ҵ��������ֽ⣬��һ�ֺܺõIJ�������
��.�Ʊ�̼��������װ����ͼ��ʾ��
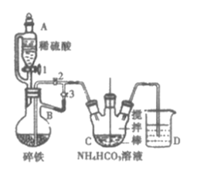
(1)����B��������___��
(2)ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬��Ŀ����___��Ȼ�����2���رջ���___��
��.�Ʊ���������������FeCO3�����м�������������Һ����75���½���ʹ֮��ַ�Ӧ��
(3)�÷�Ӧ��ѧ����ʽΪ___��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ����___����Ӧ������������Һ�л��������������IJ������£��뽫ǰ�IJ���ȷ����(д��ĸ���)��___�����
a.���� b.�������������� c.��ȴ�ᾧ d.�������Ҵ�ϴ��
��.�����������崿�ȵIJ�����
(4)��K2Cr2O7�ζ����ⶨ������Fe2+�ĺ���������Ʒ���ȣ���ȡ6.00g��Ʒ���Ƴ�250.00mL��Һ��ȡ25.00mL��0.0100mol��L-1��K2Cr2O7����Һ�ζ����յ㣬���ı�Һ20.00mL�����Ʒ��������������Ĵ���Ϊ___(������������ʾ)��
���𰸡�������ƿ �ž�װ���ڵĿ�������ֹ���������������� 1��3 2CH3CH(OH)COOH+FeCO3=[CH3CH(OH)COO]2Fe+CO2��+H2O �������� bcad 57.6%
��������
��������������;��д��������������ϡ���ᷴӦһ��ʱ�䣬�����������ų��������ų������������������뵽����װ������̼�����������Ӧ����̼�������������̼��������Ӧ�������������Ͷ�����̼���������۷�ֹ�����������ʣ���Ӧ������Ҫ���������������������������������������Ҵ�������������Ҵ�ϴ�ӣ����ݹ�ϵʽ�����������������ʵ������ټ��㴿�ȡ�
(1) ����B�Ǵ�֧�ܵ���ƿ��������������ƿ��
(2) ʵ��������£��رջ���2������1��3����������ϡ���ᷴӦһ��ʱ�䣬�����������ų���������Ŀ���ǣ��ž�װ���ڵĿ�������ֹ������������������Ȼ�����2���رջ���1��3��
(3) �����̼��������Ӧ�������������Ͷ�����̼���䷴Ӧ��ѧ����ʽΪ2CH3CH(OH)COOH+FeCO3=[CH3CH(OH)COO]2Fe+CO2��+H2O��Ϊ��ֹ�����������ʣ���������ϵ�л�Ӧ�����������ۣ���Ӧ������������Һ�л�������������壬��Ҫ���������������������������Ҫ�����������������ɣ����˺����������Ҵ�ϴ�ӣ���������Ϊ��bcad ��
(4) ���ݵ����غ㣬�����ϼ���+2���ߵ�+3������+6���͵�+3���ɵù�ϵΪ
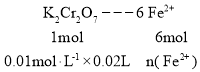
���n(Fe2+) = 1.2��10-3mol
������������Ĵ���Ϊ��![]() ��
��

 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�