题目内容
 实验室制备1,2-二溴乙烷的反应原理如下:
实验室制备1,2-二溴乙烷的反应原理如下:CH3CH2OH
| 浓硫酸 |
| 170摄氏度 |
CH2=CH2+Br2
| 加热 |
可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃分子间脱水生成乙醚.
用少量的溴和足量的乙醇制备1,2-二溴乙烷的装置如右图所示,有关数据列表如下:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g?cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)装置A中需要加入碎瓷片或不断搅拌,其最主要目的是
防止爆沸
防止爆沸
;(2)反应过程中应用冷水冷却装置D,但若过度冷却(如用冰水),B中可能的现象为:
B中长导管内液面上升
B中长导管内液面上升
.(3)反应结束后,产物中可能有有少量未反应的Br2,完成下列实验步骤提纯产品:
①将1,2-二溴乙烷粗产品置于
分液漏斗
分液漏斗
中;(填写仪器名称)②加入
氢氧化钠溶液
氢氧化钠溶液
,充分振荡反应后静置,③产物应在
下
下
层(填“上”、“下”);(4)检验产物1,2-二溴乙烷中含有溴元素,实验方法为:
取少量产物于试管中,入NaOH溶液,加热,反应后冷却,加入稀HNO3酸化后加入AgNO3溶液,生成淡黄色沉淀,证明含有溴元素
取少量产物于试管中,入NaOH溶液,加热,反应后冷却,加入稀HNO3酸化后加入AgNO3溶液,生成淡黄色沉淀,证明含有溴元素
;有机化学反应方程式为:CH2BrCH2Br+2NaOH
OHCH2BrCH2OH+2NaBr
| 加热 |
CH2BrCH2Br+2NaOH
OHCH2BrCH2OH+2NaBr
.| 加热 |
(5)处理上述实验后烧瓶A中废液的正确方法是
c
c
.a.废液冷却后直接倒入下水道中
b.废液冷却后直接倒入空废液缸中
c.废液加入适量水稀释冷却后倒入废液缸.
分析:(1)混合液体加热要防暴沸;
(2)已知1,2-二溴乙烷熔点较低过度冷却会使其凝固而使气路堵塞,导致B中气压增大;
(3)根据Br2易于NaOH反应形成水溶液,与1,2-二溴乙烷分层,再用分液漏斗分离,1,2-二溴乙烷的密度大于水,所以在下层;
(4)检验1,2-二溴乙烷中含有溴元素,要将之转化为溴离子,根据溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀来检验;
(5)实验后烧瓶A中废液不直接,倒入下水道应倒入废液缸,因为含有浓硫酸所以要先加水稀释;
(2)已知1,2-二溴乙烷熔点较低过度冷却会使其凝固而使气路堵塞,导致B中气压增大;
(3)根据Br2易于NaOH反应形成水溶液,与1,2-二溴乙烷分层,再用分液漏斗分离,1,2-二溴乙烷的密度大于水,所以在下层;
(4)检验1,2-二溴乙烷中含有溴元素,要将之转化为溴离子,根据溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀来检验;
(5)实验后烧瓶A中废液不直接,倒入下水道应倒入废液缸,因为含有浓硫酸所以要先加水稀释;
解答:解:(1)混合液体加热要防暴沸,装置A中需要加入碎瓷片或不断搅拌,防止爆沸,故答案为:防止爆沸;
(2)已知1,2-二溴乙烷熔点较低过度冷却会使其凝固而使气路堵塞,导致B中气压增大,长导管内液面上升,故答案为:B中长导管内液面上升;
(3)反应结束后,产物中可能有有少量未反应的Br2,完成下列实验步骤提纯产品:
①将1,2-二溴乙烷粗产品置于 分液漏斗中;
②Br2易于NaOH反应形成水溶液,所以加入NaOH溶液,充分振荡反应后静置,
③产物难溶于水而且密度大于水,所以在下层;
故答案为:①分液漏斗②NaOH溶液③下;
(4)检验1,2-二溴乙烷中含有溴元素,要将之转化为溴离子,根据溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀来检验,实验操作为:取少量产物于试管中,入NaOH溶液,加热,反应后冷却,加入稀HNO3酸化后加入AgNO3溶液,生成淡黄色沉淀,证明含有溴元素,其反应方程式:
CH2BrCH2Br+2NaOH
OHCH2BrCH2OH+2NaBr;
故答案为:取少量产物于试管中,入NaOH溶液,加热,反应后冷却,加入稀HNO3酸化后加入AgNO3溶液,生成淡黄色沉淀,证明含有溴元素;CH2BrCH2Br+2NaOH
OHCH2BrCH2OH+2NaBr;
(5)实验后烧瓶A中废液不直接倒入下水道,应倒入废液缸,因为含有浓硫酸所以要先加水稀释,故答案为:c;
(2)已知1,2-二溴乙烷熔点较低过度冷却会使其凝固而使气路堵塞,导致B中气压增大,长导管内液面上升,故答案为:B中长导管内液面上升;
(3)反应结束后,产物中可能有有少量未反应的Br2,完成下列实验步骤提纯产品:
①将1,2-二溴乙烷粗产品置于 分液漏斗中;
②Br2易于NaOH反应形成水溶液,所以加入NaOH溶液,充分振荡反应后静置,
③产物难溶于水而且密度大于水,所以在下层;
故答案为:①分液漏斗②NaOH溶液③下;
(4)检验1,2-二溴乙烷中含有溴元素,要将之转化为溴离子,根据溴离子可以和银离子反应生成淡黄色不溶于硝酸的沉淀来检验,实验操作为:取少量产物于试管中,入NaOH溶液,加热,反应后冷却,加入稀HNO3酸化后加入AgNO3溶液,生成淡黄色沉淀,证明含有溴元素,其反应方程式:
CH2BrCH2Br+2NaOH
| 加热 |
故答案为:取少量产物于试管中,入NaOH溶液,加热,反应后冷却,加入稀HNO3酸化后加入AgNO3溶液,生成淡黄色沉淀,证明含有溴元素;CH2BrCH2Br+2NaOH
| 加热 |
(5)实验后烧瓶A中废液不直接倒入下水道,应倒入废液缸,因为含有浓硫酸所以要先加水稀释,故答案为:c;
点评:该题较为综合,主要考查了乙醇制备1,2-二溴乙烷,掌握相关物质的基本化学性质,以及有关实验操作,是解答本题的关键,平时须注意积累相关反应知识,难度中等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).
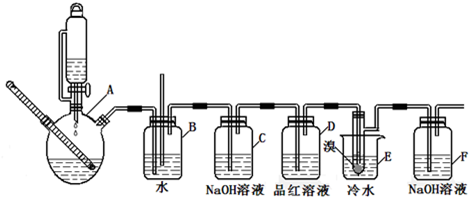
有关数据列表如表:
(1)A中药品为1:3的无水乙醇和浓硫酸混合液,写出制备乙烯的化学反应方程式: .
(2)气体发生装置使用连通滴液漏斗的原因 .
(3)装置D中品红溶液的作用是 ;同时B装置是安全瓶,监测实验进行时E中是否发生堵塞,请写出堵塞时的现象 .
(4)反应过程中应用冷水冷却装置E,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 .
(5)判断该制备反应已经结束的方法是 ;结果学生发现反应结束时,无水乙醇消耗量大大超过理论值,其原因是 .
(6)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行 (填“是”或“否”),其原因是 .

有关数据列表如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(2)气体发生装置使用连通滴液漏斗的原因
(3)装置D中品红溶液的作用是
(4)反应过程中应用冷水冷却装置E,其主要目的是
(5)判断该制备反应已经结束的方法是
(6)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行
已知实验室制备1,2-二溴乙烷可能存在的主要副反应有:乙醇在浓硫酸的存在下在l40℃脱水生成乙醚。用少量的溴和足量的乙醇制备1,2—二溴乙烷的装置如下图所示: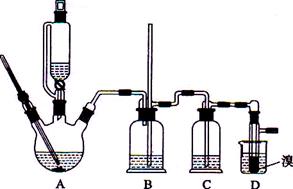
有关数据列表如下:
| | 乙醇 | 1,2-二溴乙烷 | 乙醚 |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g · cm-3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(1)反应原理是___________________________________________________________
(2)在装置C中应加入 ,(填正确选项前的字母)其目的是_______________
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断该制各反应已经结束的最简单方法是 ;
(4)若产物中有少量副产物乙醚.可用 的方法除去;
(5)反应过程中应用冷水冷却装置D,其主要目的是 ;但又不能过度冷却(如用冰水),其原因是 。
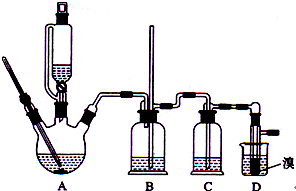 (2012?海南)实验室制备1,2-二溴乙烷的反应原理如下:
(2012?海南)实验室制备1,2-二溴乙烷的反应原理如下:
