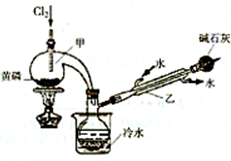
题目内容
如图是实验室制备1,2-二溴乙烷并进行一系列相关实验的装置(加热及夹持设备已略).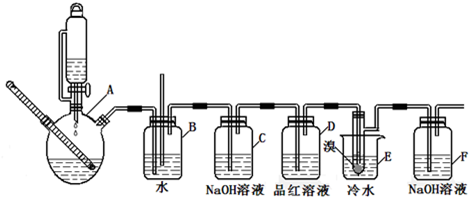
有关数据列表如表:
| 乙醇 | 1,2-二溴乙烷 | 乙醚 | |
| 状态 | 无色液体 | 无色液体 | 无色液体 |
| 密度/g/cm3 | 0.79 | 2.2 | 0.71 |
| 沸点/℃ | 78.5 | 132 | 34.6 |
| 熔点/℃ | 一l30 | 9 | -1l6 |
(2)气体发生装置使用连通滴液漏斗的原因
(3)装置D中品红溶液的作用是
(4)反应过程中应用冷水冷却装置E,其主要目的是
(5)判断该制备反应已经结束的方法是
(6)有学生提出,装置F中可改用足量的四氯化碳液体吸收多余的气体,判断改用四氯化碳液体是否可行
分析:(1)乙醇在浓硫酸作催化剂加热170℃时生成乙烯;
(2)连通滴液漏斗使上下容器中的压强相同,液体容易流下;
(3)二氧化硫能使品红褪色;如果E中发生堵塞,E中压强增大,玻璃管中液面会上升;
(4)液溴易挥发,冷水冷却,能减少液溴挥发;由表中数据可知温度太低,1,2-二溴乙烷会凝结为固体;
(5)液溴为红棕色,产物1,2-二溴乙烷为无色,根据颜色变化判断反应是否结束;乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;
(6)根据尾气的成分是乙烯和溴分析.
(2)连通滴液漏斗使上下容器中的压强相同,液体容易流下;
(3)二氧化硫能使品红褪色;如果E中发生堵塞,E中压强增大,玻璃管中液面会上升;
(4)液溴易挥发,冷水冷却,能减少液溴挥发;由表中数据可知温度太低,1,2-二溴乙烷会凝结为固体;
(5)液溴为红棕色,产物1,2-二溴乙烷为无色,根据颜色变化判断反应是否结束;乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;
(6)根据尾气的成分是乙烯和溴分析.
解答:解:(1)乙醇在浓硫酸作催化剂加热170℃时生成乙烯,其反应方程式为:CH3CH2OH
CH2=CH2↑+H2O;
故答案为:CH3CH2OH
CH2=CH2↑+H2O;
(2)连通滴液漏斗使上下容器中的压强相同,液体容易流下,所以气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下;
故答案为:使连通滴液漏斗里的溶液容易滴下;
(3)无水乙醇和浓硫酸混合液制备乙烯时,会有副产物二氧化硫生成,而二氧化硫能使品红褪色,所以用品红溶液检验二氧化硫是否被氢氧化钠吸收完全;如果E中发生堵塞,E中压强增大,玻璃管中液面会上升;
故答案为:验证二氧化硫是否被除尽;玻璃管中液面上升;
(4)液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发;由表中数据可知1,2-二溴乙烷的熔点为9℃,如用冰水冷却时温度太低,1,2-二溴乙烷会凝结为固体,从而导致导管堵塞;
故答案为:减少液溴挥发;1,2-二溴乙烷易凝结成固体而发生堵塞;
(5)液溴为红棕色,产物1,2-二溴乙烷为无色,当反应结束时液溴全部转化为1,2-二溴乙烷,E中液体由红棕色变为无色;乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;
故答案为:E中液体由红棕色变为无色;副反应发生或反应太剧烈;
(6)实验中尾气的成分是乙烯和溴,二者都易溶于四氯化碳,所以能用四氯化碳液体吸收多余的气体;
故答案为:是;乙烯和液溴均易溶于四氯化碳.
| 170℃ |
| 浓硫酸 |
故答案为:CH3CH2OH
| 170℃ |
| 浓硫酸 |
(2)连通滴液漏斗使上下容器中的压强相同,液体容易流下,所以气体发生装置使用连通滴液漏斗的原因使连通滴液漏斗里的溶液容易滴下;
故答案为:使连通滴液漏斗里的溶液容易滴下;
(3)无水乙醇和浓硫酸混合液制备乙烯时,会有副产物二氧化硫生成,而二氧化硫能使品红褪色,所以用品红溶液检验二氧化硫是否被氢氧化钠吸收完全;如果E中发生堵塞,E中压强增大,玻璃管中液面会上升;
故答案为:验证二氧化硫是否被除尽;玻璃管中液面上升;
(4)液溴易挥发,反应过程中应用冷水冷却装置E,能减少液溴挥发;由表中数据可知1,2-二溴乙烷的熔点为9℃,如用冰水冷却时温度太低,1,2-二溴乙烷会凝结为固体,从而导致导管堵塞;
故答案为:减少液溴挥发;1,2-二溴乙烷易凝结成固体而发生堵塞;
(5)液溴为红棕色,产物1,2-二溴乙烷为无色,当反应结束时液溴全部转化为1,2-二溴乙烷,E中液体由红棕色变为无色;乙醇在浓硫酸作催化剂作用下会有乙醚等副产物生成,反应太剧烈时乙醇部分挥发;
故答案为:E中液体由红棕色变为无色;副反应发生或反应太剧烈;
(6)实验中尾气的成分是乙烯和溴,二者都易溶于四氯化碳,所以能用四氯化碳液体吸收多余的气体;
故答案为:是;乙烯和液溴均易溶于四氯化碳.
点评:本题考查了1,2-二溴乙烷实验室制取、乙烯的制取、实验装置的理解评价、化学方程式的书写等,注意基础知识的掌握,本题难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备己略).
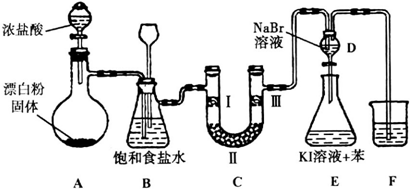
(1)装置A是氯气的发生装置,请写出相应反应的化学方程式: .
(2)装置B中饱和食盐水的作用是 :同时装置B也是安全瓶,监测实验进行时C中是否发生堵塞.请写出发生堵塞时B中的现象: .
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是 (填字母编号).(选填字母)
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性.反应一段时间后,打开活塞,将装置D中少量溶液加入装置E中,振荡,观察到的现象是 ,该现象 (填“能”或“不能”)说明溴单质的氧化性强于碘,原因是 .
(5)装置F的作用是 ,其烧杯中的溶液不能选用下列中的 (填字母编号).
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.

(1)装置A是氯气的发生装置,请写出相应反应的化学方程式:
(2)装置B中饱和食盐水的作用是
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ处依次放入物质的组合应是
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
| b | 干燥的有色布条 | 无水硫酸铜 | 湿润的有色布条 |
| c | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
| d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(5)装置F的作用是
a.饱和NaOH溶液 b.饱和Ca(OH)2溶液
c.饱和Na2SO3溶液 d.饱和Na2CO3溶液.