题目内容
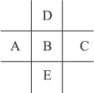
如图为周期表的一部分,其中的编号代表对应位置的元素.请回答下列问题:

(1)写出表中元素⑨原子的核外电子排布式
(2)元素④、⑤的第一电离能大小顺序是:
(3)元素③、⑧形成的化合物中心原子杂化轨道类型:
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的化学方程式
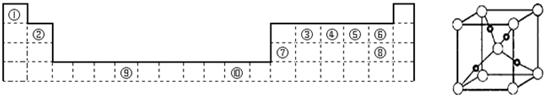
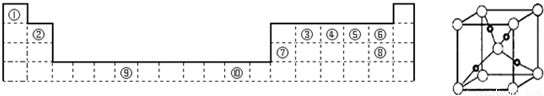
(5)如图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为
(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3 不易与Cu2+形成配离子,其主要原因是:

(1)写出表中元素⑨原子的核外电子排布式
1s22s22p63s23p63d54s1
1s22s22p63s23p63d54s1
.(2)元素④、⑤的第一电离能大小顺序是:
N
N
>O
O
;(用元素符号表示,下同)元素⑥、⑧电负性大小顺序是:F
F
>Cl
Cl
(3)元素③、⑧形成的化合物中心原子杂化轨道类型:
sp3
sp3
,分子的空间构型正四面体
正四面体
(4)已知某些不同族元素的性质也有一定的相似性,如元素②与元素⑦的氢氧化物有相似的性质.写出元素②的氢氧化物与NaOH溶液反应的化学方程式
Be(OH)2+2NaOH═2H2O+Na2BeO2
Be(OH)2+2NaOH═2H2O+Na2BeO2
(5)如图是⑩的某种氧化物的晶胞结构示意图(顶角和体心是氧),可确定该氧化物的化学式为
Cu2O
Cu2O
.(6)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子.已知NF3与NH3的结构类似,但NF3 不易与Cu2+形成配离子,其主要原因是:
NF3分子中氟原子电负性强,吸引孤对电子能力强
NF3分子中氟原子电负性强,吸引孤对电子能力强
.分析:(1)由元素在周期表中的位置可知,⑨是26号Cr元素,根据核外电子排布规律书写其核外电子排布式;
(2)④是N元素,⑤是O元素,N元素2p能级有3个电子,处于半满稳定状态,能量较低,失去第一个电子需要能量更多;
⑥是F元素,⑧Cl元素,同主族自上而下电负性减小;
(3)③是C元素,⑧Cl元素,二者形成物质为CCl4,C原子成4个C-Cl键,不含孤电子对,杂化轨道数为4,据此判断杂化方式与空间结构;
(4)②是Be元素,⑦是Al元素,二者性质相似,根据氢氧化铝与氢氧化钠的反应可知,故Be(OH)2与氢氧化钠溶液反应生成Na2BeO2、H2O;
(5)⑩是Cu元素,晶胞中顶角和体心是氧原子,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,利用均摊法计算O原子数目,据此确定化学式;
(6)NF3分子中氟原子电负性强,吸引孤对电子能力强;
(2)④是N元素,⑤是O元素,N元素2p能级有3个电子,处于半满稳定状态,能量较低,失去第一个电子需要能量更多;
⑥是F元素,⑧Cl元素,同主族自上而下电负性减小;
(3)③是C元素,⑧Cl元素,二者形成物质为CCl4,C原子成4个C-Cl键,不含孤电子对,杂化轨道数为4,据此判断杂化方式与空间结构;
(4)②是Be元素,⑦是Al元素,二者性质相似,根据氢氧化铝与氢氧化钠的反应可知,故Be(OH)2与氢氧化钠溶液反应生成Na2BeO2、H2O;
(5)⑩是Cu元素,晶胞中顶角和体心是氧原子,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,利用均摊法计算O原子数目,据此确定化学式;
(6)NF3分子中氟原子电负性强,吸引孤对电子能力强;
解答:解:(1)由元素在周期表中的位置可知,⑨是26号Cr元素,核外电子排布式为1s22s22p63s23p63d54s1,
故答案为:1s22s22p63s23p63d54s1;
(2)④是N元素,⑤是O元素,N元素2p能级有3个电子,处于半满稳定状态,能量较低,失去第一个电子需要能量更多,故第一电离能N>O,
⑥是F元素,⑧Cl元素,同主族自上而下电负性减小,故电负性F>Cl;
故答案为:N;O;F;Cl;
(3)③是C元素,⑧Cl元素,二者形成物质为CCl4,C原子成4个C-Cl键,不含孤电子对,杂化轨道数为4,杂化方式为sp3,为正四面体结构,故答案为:sp3;正四面体;
(4)②是Be元素,⑦是Al元素,二者性质相似,根据Al与氢氧化钠的反应可知,故Be(OH)2与氢氧化钠溶液反应生成Na2BeO2、H2O,反应方程式为Be(OH)2+2NaOH═2H2O+Na2BeO2,
故答案为:Be(OH)2+2NaOH═2H2O+Na2BeO2;
(5)⑩是Cu元素,晶胞中顶角和体心是氧原子,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,晶胞中含有O原子数目为1+8×
=2,故Cu原子与O原子数目之比为4:2=2:1,该氧化物化学式为Cu2O,故答案为:Cu2O;
(6)NF3分子中氟原子电负性强,吸引孤对电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键,故答案为:NF3分子中氟原子电负性强,吸引电子能力强.
故答案为:1s22s22p63s23p63d54s1;
(2)④是N元素,⑤是O元素,N元素2p能级有3个电子,处于半满稳定状态,能量较低,失去第一个电子需要能量更多,故第一电离能N>O,
⑥是F元素,⑧Cl元素,同主族自上而下电负性减小,故电负性F>Cl;
故答案为:N;O;F;Cl;
(3)③是C元素,⑧Cl元素,二者形成物质为CCl4,C原子成4个C-Cl键,不含孤电子对,杂化轨道数为4,杂化方式为sp3,为正四面体结构,故答案为:sp3;正四面体;
(4)②是Be元素,⑦是Al元素,二者性质相似,根据Al与氢氧化钠的反应可知,故Be(OH)2与氢氧化钠溶液反应生成Na2BeO2、H2O,反应方程式为Be(OH)2+2NaOH═2H2O+Na2BeO2,
故答案为:Be(OH)2+2NaOH═2H2O+Na2BeO2;
(5)⑩是Cu元素,晶胞中顶角和体心是氧原子,Cu原子处于晶胞内部,晶胞中含有4个Cu原子,晶胞中含有O原子数目为1+8×
| 1 |
| 8 |
(6)NF3分子中氟原子电负性强,吸引孤对电子能力强,使得氮原子上的孤对电子难于与Cu2+形成配位键,故答案为:NF3分子中氟原子电负性强,吸引电子能力强.
点评:本题考查元素周期表的结构、核外电子排布规律、电离能与电负性、晶胞计算、杂化轨道与分子结构等,难度中等,注意整体把握周期表的结构,(6)中注意电负性对孤对电子的影响.

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目