题目内容
【题目】石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质。设计的提纯和综合应用工艺如下:
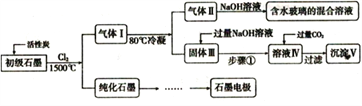
(注:SiCl4的沸点是57.6C,金属氯化物的沸点均高于150C)
(1)向反应器中通入Cl2前,需通一段时间的N2,主要目的是______________________。
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物。气体I中生成的气体除氯化物外,还有______________________(填化学式)。气体II通入NaOH溶液中得到水玻璃的化学反应方程式为________;
(3)步骤①为:搅拌、_______________;
(4)由溶液IV生成沉淀V的总反应的离子方程式为_______________。
【答案】 排除系统中的空气,防止石墨被氧化 CO SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O 过滤 AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
【解析】高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO,SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,固体Ⅲ存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,过滤得到的溶液中含有偏铝酸钠、过量的氢氧化钠,在溶液中通入过量的二氧化碳生成氢氧化铝沉淀。
(1)石墨化学性质在常温下稳定,而在高温下可与氧气发生反应,所以通入氮气排尽装置中的空气,防止石墨发生氧化反应,减少石墨损失,故答案为:排尽装置中的空气,防止石墨被氧化;
(2)石墨过量高温反应后,石墨中氧化物杂质均转变为相应的氯化物,根据杂质的含量可知,气体I中氯化物主要为SiCl4、AlCl3、FeCl3等,气体I中碳氧化物主要为CO;SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃,80℃冷却得到的气体Ⅱ含有SiCl4及CO,SiCl4与氢氧化钠溶液反应得到硅酸钠与氯化钠,化学反应方程式为:SiCl4+6NaOH= Na2SiO3+4NaCl+3H2O,故答案为:CO;SiCl4+6NaOH=Na2SiO3+4NaCl+3H2O;
(3)金属氯化物的沸点均高于150℃,则固体Ⅲ中存在AlCl3、FeCl3、MgCl2,其中FeCl3、MgCl2与过量的氢氧化钠溶液反应得到沉淀,而氯化铝与过量的氢氧化钠溶液反应生成偏铝酸钠,搅拌、过滤得到溶液IV,溶液IV中的阴离子有:AlO2-、OH-、Cl-,故答案为:过滤;
(4)溶液IV中的阴离子有:AlO2-、OH-、Cl-,通入过量二氧化碳反应生成氢氧化铝沉淀,反应的离子方程式为AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-,故答案为:AlO2-+CO2+2H2O= Al(OH)3↓+HCO3-。

【题目】在一定温度下,冰醋酸加水稀释过程中,溶液的导电能力I随加入水的体积V变化的曲线如图所示.请完成下列问题:
(1)a、b、c三点处,溶液的c(H+)由小到大的顺序为
(2)a、b、c三点处,电离程度最大的是
(3)表是几种常见弱酸的电离平衡常数(25℃):
酸 | 电离方程式 | 电离平衡常数K |
CH3COOH | CH3COOHCH3COO﹣+H | K=1.76×10﹣5 |
H2CO3 | H2CO3H++HCO3﹣H2CO3﹣H++HCO32﹣ | K1=4.31×10﹣7K2=5.61×10﹣11 |
HClO | HClOH++ClO﹣ | K=3.0×10﹣8 |
CH3COOH、H2CO3、HClO,其中酸性最强的是 , 最弱的是
(4)写出下列各物质在水溶液中发生电离的电离方程式.
①H2SO4
②NH3H2O . 
