题目内容
【题目】下列有关性质的比较,不能用元素周期律解释的是
A. 金属性:Na>Mg B. 酸性:H2SO4>H2SiO3
C. 稳定性:HCl> HBr D. 同浓度溶液的碱性:Na2CO3> NaHCO3
【答案】D
【解析】A. 同周期自左向右金属性逐渐减弱,则金属性;Na>Mg,A不符合题意;B.非金属性S>Si,非金属性越强,最高价含氧酸的酸性越强,则酸性:H2SO4>H2SiO3,B不符合题意;C.同主族自上而下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则稳定性:HCI>HBr,C不符合题意;D.碳酸根的水解程度大于碳酸氢根,溶液碱性强于碳酸氢钠,与元素周期律没有关系,D符合题意,答案选D。

 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案 名师点睛字词句段篇系列答案
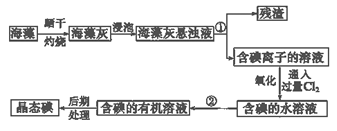
名师点睛字词句段篇系列答案【题目】元素推断题:
X、Y、Z、W为四种短周期元素,其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如下图所示:
X | Y | |
Z | W |
请回答下列问题:
(1)W位于周期表中第 周期,第 族。
(2)X可形成双原子分子,其分子的电子式是 ;Y和氢元素形成的10电子微粒中常见的+1价阳离子为 (填化学式,下同);Z和氢元素形成的18电子微粒中常见的-1价阴离子为 。
(3)工业上将干燥的W单质通入熔融的Z单质中可制得化合物Z2W2,该物质可与水反应生成一种能使品红溶液褪色的气体,0.2mol该物质参加反应时转移0.3mol电子,其中只有一种元素化合价发生改变,写出Z2W2与水反应的化学方程式 。
(4)在一定条件下,由元素Y和Z组成的一种气态化合物可发生催化氧化反应,反应达平衡进有三种气态物质共存,已知每转移4mol电子放热190.0kJ,该反应的热化学方程式为 。
【题目】亚硝酸钠(NaNO2)外观酷似食盐且有咸味,是一种常用的发色剂和防腐剂,使用过量会使人中毒,国际上对食品中亚硝酸钠的用量控制在很低的水平上。某学习小组针对亚硝酸钠设计了如下实验:
【实验I】制备NaNO2
该小组查阅资料知:2NO+Na2O2=2NaNO2; 2NO2+Na2O2=2NaNO3
设计制备装置如下(夹持装置略去):
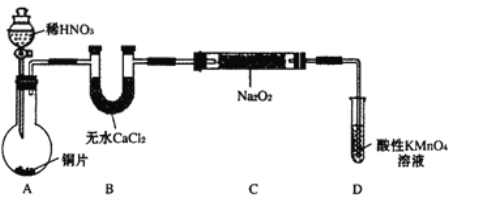
(1)装置D可将剩余的NO氧化成NO3-,发生反应的离子方程式为 。
(2)如果没有B装置,C中发生的副反应有 , 。
(3)甲同学检查完装置气密性良好后进行实验,发现制得的NaNO2中混有较多的NaNO3杂质。于是在A与B装置间增加了 装置,改进后提高了NaNO2的纯度。
【实验Ⅱ】测定制取的样品中NaNO2的含量
步骤:
a.在5个有编号的带刻度试管(比色管)中分别加入不同量的NaNO2溶液,各加入1 mL的M溶液(M遇NaNO2呈紫红色,NaNO2浓度越大颜色越深),再加蒸馏水至总体积均为10 mL并振荡,制成标准色阶:

b.称量0.10 g制得的样品溶于水配成500 mL溶液。取5 mL待测液,加入1 mL M溶液,后加蒸馏水至10 mL振荡,与标准色阶比较。
(4)步骤b中比较结果是:待测液颜色与③号色阶相同。则甲同学制得的样品中NaNO2的质量分数是 %。
(5)用目视比色法证明维生素C可以有效降低NaNO2的含量。设计并完成下列实验报告。
实验方案 | 实验现象 | 实验结论 |
取5mL待测液加入 ,振荡,再加入1ml M溶液 , ,再振荡,与③号色阶对比。 | 维生素C可以有效降低NaNO2 的含量。 |
【题目】NaCl和NaClO在酸性条件下可发生反应:ClO- + Cl- + 2H+ = Cl2↑+ H2O,某学习小组拟研究消毒液(主要成分为NaCl和NaClO)的变质情况。
(1)此消毒液中NaClO可吸收空气中的CO2生成NaHCO3和HClO而变质。写出此化学反应方程式 。
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出。通过以下装置检验气体的成分可以判断消毒液的变质情况。
限选试剂为:98%浓硫酸、1%品红溶液、1.0 mol·L-1 KI-淀粉溶液、1.0 mol·L-1NaOH、
澄清石灰水、饱和NaCl溶液
请完成下列探究实验方案。
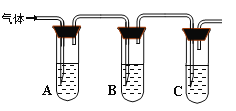
所加试剂 | 预期现象和结论 |
试管A中加足量① ; 试管B中加1%品红溶液; 试管C中加② 。 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊。则消毒液部分变质; ③ 则消毒液未变质; ④ 则消毒液完全变质。 |
(3)用滴定法测定消毒液中NaClO的浓度。实验步骤如下:
① 量取 25.00 mL消毒液放入锥形瓶中,加入过量的a mol·L-1 Na2SO3溶液b mL;
② 滴定分析。将c mol·L-1的酸性KMnO4溶液装入 (填酸式或碱式)滴定管中;KMnO4和剩余的Na2SO3发生反应。当溶液由无色变成浅红色,且保持半分钟内红色不褪时,停止滴定,记录数据。重复滴定实验2次,平均消耗酸性KMnO4溶液v mL;
滴定过程中涉及的反应有:NaClO+Na2SO3=NaCl+Na2SO4;
2KMnO4+5Na2SO3+3H2SO4=K2SO4+2MnSO4+5Na2SO4+3H2O
③ 计算消毒液中NaClO的浓度为 mol·L-1(用含a、b、c、v的代数式表示)。