题目内容
7.在呼吸面具中Na2O2与CO2反应生成Na2CO3和O2.下列说法正确的是( )| A. | 在该反应中,每生成0.1mol氧气转移0.2mol电子 | |
| B. | Na、Na2O2中钠元素微粒的半径:r(Na)<r(Na+) | |
| C. | 元素氧的单质只存在氧气和臭氧两种同素异形体 | |
| D. | 在该反应条件下,氧元素的非金属性强于碳元素的非金属性 |
分析 A、过氧化钠中氧元素的化合价为-1价,生成0.1mol氧气转移了0.2mol电子;
B、原子失去最外层电子形成阳离子,半径减小;
C、由同种元素组成的不同种单质为同素异形体;
D、比较非金属性可通过以下角度:①氢化物的稳定性,②与氢气反应的难易程度,③最高价氧化物对应的水化物的酸性,④单质之间的置换反应,⑤对应阴离子的还原性强弱,⑥与变价金属反应的化合价高低等.
解答 解:A、过氧化钠中氧元素为-1价,则过氧化钠与水反应时,生成0.1mol氧气转移0.2mol电子,转移的电子数为0.2NA,故A正确;
B、钠原子失去最外层电子形成的钠离子半径小于钠原子,故B错误;
C、元素氧的单质存在氧气、臭氧、O4等多种同素异形体,故C错误;
D、过氧化钠和二氧化碳反应生成氧气,反应中过氧化钠自身氧化还原反应,不能判断氧元素和碳元素的非金属性,故D错误;
故选A.
点评 本题考查了钠的性质分析,原子结构的理解应用,注意同素异形体概念的分析,掌握基础是解题关键,题目较简单.

练习册系列答案
 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案
相关题目
15.下列实验或操作正确的是( )


| A. | 实验Ⅰ:制氨气 | |
| B. | 实验Ⅱ:蒸发、浓缩、结晶 | |
| C. | 实验Ⅲ:配制1:1的稀硫酸 | |
| D. | 实验Ⅳ:用KMnO4标准溶液滴定未知浓度的Na2SO3溶液 |
12.下列指定反应的离子方程式正确的是( )
| A. | NO2与水的反应:3NO2+H2O═2H++2NO3-+NO | |
| B. | 向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH-$\frac{\underline{\;△\;}}{\;}$NH3↑+H2O | |
| C. | 醋酸溶液与水垢中的CaCO3反应:2H++CaCO3═Ca2++H2O+CO2↑ | |
| D. | 用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-═Ag++NO↑+H2O |
16.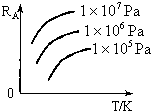 已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )
已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )
 已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )
已知反应mA(g)+nB(g)?xC(g)+yD(g),A的转化率RA与p、T的关系如图,根据图示可以得出的正确结论是( )| A. | 正反应吸热,m+n>x+y | B. | 正反应吸热,m+n<x+y | ||
| C. | 正反应放热,m+n>x+y | D. | 正反应放热,m+n<x+y |
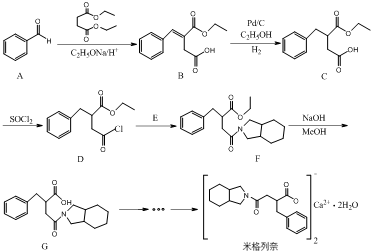
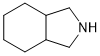 .
.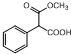 )为C的同系物,写出符合下列条件的X的一种同分异构体的结构简式:
)为C的同系物,写出符合下列条件的X的一种同分异构体的结构简式: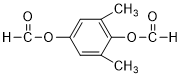 或
或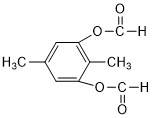 或
或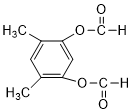 (以上一种即可).
(以上一种即可).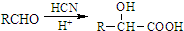 ②
②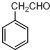 为原料制备
为原料制备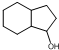 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下: