题目内容
【题目】某同学用胆矾晶体(CuSO4·5H2O)配制0.05mol/L的CuSO4溶液980mL,回答下列问题:
(1)所需仪器为:托盘天平、药匙、烧杯、胶头滴管,还需要那些主要玻璃仪器才能完成该实验,请写出: 、 。
(2)请写出该实验的简要的实验步骤:
①计算;②称量胆矾 g;③ ;
④转移;⑤洗涤并转移;⑥定容;⑦摇匀。
(3)如图是该同学转移溶液的示意图,图中的错误是:
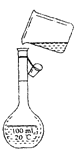
① 、
② 。
(4)在配制CuSO4溶液时,下列操作中会导致结果偏低 (请用序号填写)。
① 用托盘天平称量时砝码放在左盘
② 将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外
③ 定容时俯视刻度线
④ 定容时仰视刻度线
⑤ 干净的容量瓶未经干燥就用于配制溶液
【答案】(1)1000mL容量瓶、玻璃棒
(2)②12.5③溶解
(3)未用玻璃棒引流;未使用1000mL容量瓶
(4)①②④
【解析】试题分析:(1)要完成实验需要玻璃棒、实验室没有980mL容量瓶,选择1000mL容量瓶;(2)实验室没有980mL容量瓶,选择1000mL容量瓶.需硫酸铜晶体的质量为m=1L×0.05mol/L×250g/mol=12.5g,溶液配制一般步骤是:计算→称量→溶解、冷却→移液→洗涤→定容→摇匀→装瓶贴签;(3)右图是该同学转移溶液的示意图,图中的错误是:未使用1000mL容量瓶,转移溶液时不能直接倾倒,应用玻璃棒引流;
(4)①用托盘天平称量时砝码放在左盘,称得胆矾的质量偏小,会导致溶液浓度小;
②将烧杯中的溶液转移到容量瓶时不慎洒到容量瓶外,溶质偏小,会导致溶液浓度小;
③定容时俯视刻度线,溶液体积偏小,会导致溶液浓度偏大;
④定容时仰视刻度线,溶液体积偏大,会导致溶液浓度偏小;
⑤干净的容量瓶未经干燥就用于配制溶液,无影响。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目