题目内容
6.下列叙述正确的是( )| A. | 铝制容器可盛装热的浓H2SO4 | |
| B. | AgI胶粒在电场中自由运动 | |
| C. | K与水反应比Li与水反应剧烈 | |
| D. | 铅蓄电池在放电过程中,负极质量减小,正极质量增加 |
分析 A.加热条件下,铝和浓硫酸反应;
B.AgI胶粒带电荷,在电场中定向移动;
C.元素的金属性越强,其单质与水或酸反应越剧烈;
D.铅蓄电池放电时,负极电极反应式为:Pb+SO42--2e-=PbSO4 ;正极电极反应式为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O.
解答 解:A.加热条件下,铝和浓硫酸反应生成硫酸铝和二氧化硫,常温下二者发生钝化现象,所以铝制容器不能盛放热的浓硫酸,故A错误;
B.AgI胶粒带电荷,在电场中定向移动,故B错误;
C.元素的金属性越强,其单质与水或酸反应越剧烈,金属性K>Li,所以K与水反应比Li与水反应剧烈,故C正确;
D.铅蓄电池放电时,负极电极反应式为:Pb+SO42--2e-=PbSO4 ;正极电极反应式为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O,根据电极反应式知,正负极质量都增大,故D错误;
故选C.
点评 本题考查金属性强弱判断、原电池原理、铝的性质、胶体等知识点,综合性较强,侧重考查元素化合物知识及基本理论,易错点是D选项,能正确书写电极反应式即可解答,题目难度不大.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
16.2006年10月29日,我国自主研发的通信广播卫星“鑫诺二号”发射成功.发射该卫星的“长征三号乙”运载火箭采用的是世界上最先进的液氢/液氧推进剂.现有氢气和氧气反应的两个热化学方程式:
①2H2(g)+O2(g)═2H2O(l);△H1=-571.6kJ•mol-1
②2H2(l)+O2(l)═2H2O(g);△H2=-482.6kJ•mol-1
则H2的燃烧热为( )
①2H2(g)+O2(g)═2H2O(l);△H1=-571.6kJ•mol-1
②2H2(l)+O2(l)═2H2O(g);△H2=-482.6kJ•mol-1
则H2的燃烧热为( )
| A. | 571.6 kJ•mol-1 | B. | 482.6 kJ•mol-1 | C. | 285.8 kJ•mol-1 | D. | 241.3 kJ•mol-1 |
17.乙烯酮(CH2=C=O)在一定条件下,能与含活泼氢的化合物发生如下反应,其反应可表示为:CH2=C=O+HA→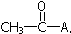 .下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )
.下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )
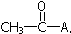 .下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )
.下列各试剂,在一定条件下与乙烯酮发生反应,其产物不正确的是( )| A. | HCl与之加成,生成CH3COCl | B. | CH3OH与之加成,生成CH3COCH2OH | ||
| C. | H2O与之加成,生成CH3COOH | D. | CH3COOH与之加成,生成 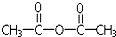 |
11.下列有关有机物同分异构体说法中不正确的是( )
| A. | 分子式为C4H8的同分异构体共有(不考虑立体异构)5种 | |
| B. | 立方烷(C8H8)的六氯取代物有3种 | |
| C. | 分子式为C5H10O2的同分异构体中属于酯的有8种 | |
| D. | CH3 OCH3的一溴取代物有4种 OCH3的一溴取代物有4种 |
18.下列各项表达中正确的是( )
| A. | CS2的结构式:S=C=S | |
| B. | HCO-3的水解HCO3-+H2O?H3O++CO32- | |
| C. | 乙酸的结构简式:C2H6O2 | |
| D. | Mg2+的结构示意图: |
15.根据下列短周期元素性质的数据判断,下列说法正确的是( )
| 元素编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径/10-10m | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 1.43 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
| A. | 元素⑦位于第3周期ⅤA族 | |
| B. | 元素⑤⑥形成的化合物是共价化合物 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物碱性最强 |
16.下列关于化石燃料煤、石油和天然气的说法中,不正确的是( )
| A. | 石油是多种碳氢化合物的混合物,可据各组分沸点不同进行分馏利用 | |
| B. | 煤的气化、液化是物理变化,煤的干馏是化学变化 | |
| C. | 天然气的主要成分是甲烷 | |
| D. | 酸雨形成的主要原因是含硫化石燃料的大量燃烧 |
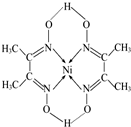 (1)第一电离能介于B、N之间的第二周期元素有3种.
(1)第一电离能介于B、N之间的第二周期元素有3种.