题目内容
已知A、B、C、D是1~18号元素中的四种,0.5molA元素的离子得到6.02×1023个电子被还原为中性原子,0.4gA的氧化物恰好与100mL0.2mol/L的盐酸完全反应,A原子核内质子数与中子数相等。B是地壳中含量最多的金属元素。C得到一个电子后与氩的电子层结构相同,其最高价氧化物的水化物为自然界最强的酸。D元素是构成有机物的主要元素,其最外层电子数是最内层电子数的2倍。k*s5u**
(1)元素D 在周期表中的位置是 。
(2)元素A的原子结构示意图为 。
(3)A的单质可在D的最高价氧化物中燃烧得到一种白色固体和一种黑色固体,试写出其化学方程式 。
(4)C的单质可用于生产漂白粉,该反应的化学方程式为 。
(5)向10mL浓度为1mol/L的B、C两元素形成的化合物的水溶液里逐滴滴入35mL浓度为1mol/L的苛性钠溶液,现象是______________________。
(1)第2周期第ⅣA族
 |
(2)
(3)2Mg+CO2![]() 2MgO+C
2MgO+C
(4)2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
(5)产生白色沉淀,后沉淀部分溶解。k*s5u**

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
已知A、B、C、D是原子序数依次增大的短周期主族元素,A、B、C分别在不同周期,A与C同主族,B的一种单质能使带火星的木条复燃,A、C、D三种原子的最外层电子数之和为6.下列说法不正确的是( )
| A、A的原子半径比B的小 | B、B与C形成的化合物只有一种 | C、C在化合物中呈+1价 | D、D单质的晶体可用作半导体材料 |
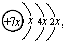 ,B是同周期中原子第一电离能最小的元素,C原子的最外层有三个未成对电子,E是人们日常生活中最常用的金属.
,B是同周期中原子第一电离能最小的元素,C原子的最外层有三个未成对电子,E是人们日常生活中最常用的金属.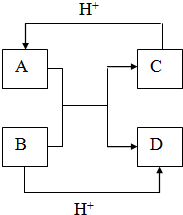 已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.
已知A、B、C、D是中学化学中常见的四种不同微粒,它们之间存在如图所示的转化关系.