题目内容
【题目】根据要求回答下列有关问题。
(1)甲醇是一种重要的化工原料,工业上利用CO2和H2在一定条件下反应合成甲醇。已知:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:___。
(2)高炉炼铁是冶炼铁的主要方法,发生的主要反应为:Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__,温度升高后,K值__(填“增大”、“不变”或“减小”)。
2Fe(s)+3CO2(g) H=-28.5kJ/mol,冶炼铁反应的平衡常数表达式K=__,温度升高后,K值__(填“增大”、“不变”或“减小”)。
(3)在T℃时,反应Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
2Fe(s)+3CO2(g)的平衡常数K=64,在2L恒容密闭容器中,按下表所示加入物质,经过一段时间后达到平衡。
Fe2O3 | CO | Fe | CO2 | |
始态mol | 1.0 | 1.0 | 1.0 | 1.0 |
①平衡时CO 的转化率为___。
②下列情况标志反应达到平衡状态的是__(填字母)。
a.容器内气体密度保持不变
b.容器内气体压强保持不变
c.CO的消耗速率和CO2的生成速率相等
d.容器内气体的平均相对分子质量保持不变
【答案】CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-442.8kJ·mol-1 K=![]() 减小 60% ad
减小 60% ad
【解析】
(1)甲醇不完全燃烧生成一氧化碳和液态水的化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l),根据盖斯定律计算反应热;
(2)平衡常数等于生成物的浓度系数次幂之积除以反应物浓度系数次幂之积;根据温度对平衡移动的影响判断温度对平衡常数的影响
(3)①浓度商Qc=1,小于平衡常数,反应向正反应进行,利用三段式表示出平衡时各组分的物质的量浓度,根据平衡常数列方程计算,在结合转化率定义计算;
②根据平衡时正逆反应速率相等,各组分的含量不变进行判断。
(1)已知:①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH1=-1275.6kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) ΔH2=-566.0kJ·mol-1
③H2O(g)=H2O(l) ΔH3=-44.0kJ·mol-1
甲醇不完全燃烧生成一氧化碳和液态水的化学方程式为:CH3OH(l)+O2(g)=CO(g)+2H2O(l) ,反应可由(①②)/2+③×2得到,根据盖斯定律,该反应的焓变为△H=(△H1△H2)/2+2△H3=442.8kJ/mol,
故答案为:CH3OH(l)+O2(g)=CO(g)+2H2O(l) ΔH=-442.8kJ·mol-1;
(2) Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g) H=-28.5kJ/mol的平衡常数表达式K=
2Fe(s)+3CO2(g) H=-28.5kJ/mol的平衡常数表达式K=![]() ,该反应是放热反应,升高温度平衡逆向进行,平衡常数减小;
,该反应是放热反应,升高温度平衡逆向进行,平衡常数减小;
故答案为:K=![]() ;减小;
;减小;
(3)①在T℃时,该反应的平衡常数K=64,容器内浓度商Qc=1,小于平衡常数,反应向正反应进行,设消耗一氧化碳物质的量为x,则:
Fe2O3(s)+3CO(g)![]() 2Fe(s)+3CO2(g)
2Fe(s)+3CO2(g)
起始量(mol): 1 1
变化量(mol): x x
平衡量(mol): 1x 1+x
反应前后气体体积不变,可以用物质的量代替浓度计算平衡常数,故(1+x)3/(1x)3=64 ,x=0.6,故CO的转化率=0.6mol/1mol×100%=60%,
故答案为:60%;
②a. 由于反应物和生成物中都有固体物质参加,且平衡前混合气体的总质量会变化,只有平衡时混合气体的总质量才保持不变,密度才不变,a正确;
b. 反应时气态物质体积保持不变的反应,则反应前后气态物质的物质的量保持不变,则平衡前后气体的压强不变,b错误;
c. .CO的消耗速率和CO2的生成速率均为正反应速率,c错误;
d. 据平均相对分子质量=气体总质量/气体总物质的量,反应中气体物质的量是定值,只有平衡时,质量才不变,平均相对分子质量才不变,故d正确;
故选ad。

 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案【题目】镍与VA族元素形成的化合物是重要的半导体材料,应用最广泛的是砷化镓(GaAs),回答下列问题:
(1)基态Ga原子的核外电子排布式为_____,基态As原子核外有_________个未成对电子。
(2)镓失去电子的逐级电离能(单位:kJ·mol-1)的数值依次为577、1984.5、2961.8、6192由此可推知镓的主要化合价为____和+3。砷的电负性比镍____(填“大”或“小”)。
(3)比较下列镓的卤化物的熔点和沸点,分析其变化规律及原因:________________________。
镓的卤化物 | GaCl3 | GaBr3 | GaI3 |
熔点/℃ | 77.75 | 122.3 | 211.5 |
沸点/℃ | 201.2 | 279 | 346 |
GaF3的熔点超过1000 ℃,可能的原因___________________________________________。
(4)二水合草酸镓的结构如图所示,其中镓原子的配位数为______,草酸根中碳原子的杂化方式为______________。

(5)砷化镓熔点为1238℃,立方晶胞结构如图所示,晶胞参数为a=565 pm。该晶体的类型为_________,晶体的密度为___________(设NA为阿伏加德罗常数的数值,列出算式即可)g·cm-3。

【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号___,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
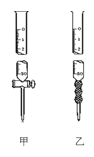
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___中,该仪器的名称是___。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:___(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断达到滴定终点的现象是:___。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液的读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.28 |
2 | 20.00 | 0.00 | 18.24 |
通过计算可得,该盐酸浓度为:___mol·L-1(计算结果保留2位小数)。