题目内容
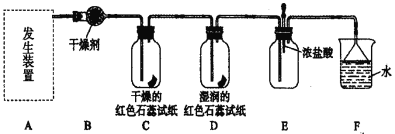
【题目】某化学兴趣小组为了制取并探究氨气性质,按下列装置(部分夹持装置已略去)进行实验。[制取氨气的反应原理:2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+2H2O ]
CaCl2 + 2NH3↑+2H2O ]
(实验探究)
(1)利用上述原理,实验室制取氨气应选用下图中________发生装置进行实验。

(2)B装置中的干燥剂可选用________。
(3)用5.35 g NH4Cl固体与足量Ca(OH)2反应,最多可制得标准状况下氨气的体积为________ L。(NH4Cl的摩尔质量为53.5g·mol—1)
(4)气体通过C、D装置时,试纸颜色会发生变化的是____(填“C”或“D”)。
(5)当实验进行一段时间后,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,可观察到的现象是_______。
(6)F装置中倒置漏斗的作用_______。
(拓展应用)
(7)某同学用如图所示装置进行氨气的性质实验,根据烧瓶内产生红色喷泉的现象,说明氨气具有________性质(填序号)。
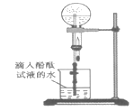
a 还原性 b 极易溶于水 c 与水反应生成碱性物质
(8)氨气的用途很广。如可用氨气处理二氧化氮:8NH3 + 6NO2 =7N2 + 12H2O
该反应中氨气体现________(填“氧化性”或“还原性”)。请你列举出氨气的另一种用途________。
【答案】a 碱石灰 2.24 D 产生白烟 防止倒吸 b c 还原性 致冷剂;氮肥(或化肥)的原料;硝酸的原料;化工原料
【解析】
实验室制氨气选用固固加热型装置,生成氨气、水和氯化钙,碱石灰干燥剂吸收水,氨气极易溶于水,显碱性,尾气处理时要防止倒吸。
(1)实验室制取氨气为固固加热型装置,应选用a发生装置进行实验。
(2)氨气是碱性气体,B装置中的干燥剂可选用碱石灰。
(3)用5.35 g NH4Cl固体的物质的量为0.1mol,与足量Ca(OH)2反应,2NH4Cl + Ca(OH)2 ![]() CaCl2 + 2NH3↑+2H2O,最多可制得标准状况下氨气的体积为0.1mol×22.4L/mol=2.24L。
CaCl2 + 2NH3↑+2H2O,最多可制得标准状况下氨气的体积为0.1mol×22.4L/mol=2.24L。
(4)氨气遇水生成氨水显碱性,气体通过C、D装置时,试纸颜色会发生变化的是D。
(5)当实验进行一段时间后,E装置充满了氨气,挤压E装置中的胶头滴管,滴入1~2滴浓盐酸,浓盐酸具有挥发性,产生大量氯化氢气体与氨气结合,可观察到的现象是产生白烟。
(6)氨气极易溶于水,F装置中倒置漏斗的作用防止倒吸。
(7)某同学进行氨气的性质实验,氨气极易溶于水,使烧瓶内气压迅速下降,烧杯水倒吸,酚酞遇碱变红,烧瓶内产生红色喷泉的现象,说明氨气具有b c性质。
(8)氨气处理二氧化氮:8NH3 + 6NO2 =7N2 + 12H2O,根据氧化还原反应原理,氮元素化合价升高,作还原剂,体现了氨气还原性。氨气的其余用途:致冷剂;氮肥(或化肥)的原料;硝酸的原料;化工原料。

 阅读快车系列答案
阅读快车系列答案【题目】用如图所示装置进行实验,下列对实验现象的解释不合理的是

选项 | ①试剂 | ①中现象 | 解释 |
A | 品红溶液 | 溶液褪色 | SO2具有漂白性 |
B | Na2SiO3溶液 | 产生胶状沉淀 | 酸性: H2SO3 >H2SiO3 |
C | 酸性KMnO4溶液 | 紫色褪去 | SO2具有还原性 |
D | Ba(NO3)2溶液 | 生成白色沉淀 | SO32-与Ba2+生成 白色BaSO3沉淀 |
A.AB.BC.CD.D