题目内容
【题目】[化学——选修3:物质结构与性质]磷存在于人体所有细胞中,是维持骨骼和牙齿的必要物质,几乎参与所有生理上的化学反应。回答下列问题:
(1)基态P原子的核外电子排布式为 ________,有________个未成对电子。
(2)磷的一种同素异形体——白磷(P4)的立体构型为________,其键角为__________,推测其在CS2中的溶解度________(填“大于”或“小于”)在水中的溶解度。
(3)两种三角锥形气态氢化物膦(PH3)和氨(NH3)的键角分别为93.6和107,试分析PH3的键角小于NH3的原因 ______________________________。
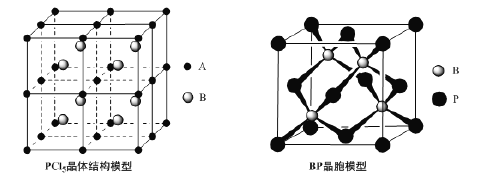
(4)常温下PCl5是一种白色晶体,其立方晶系晶体结构模型如上左图所示,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,则A为______,其中心原子杂化轨道类型为__________,B为________。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,上右图为其立方晶胞,其中的每个原子均满足8电子稳定结构,试判断其熔点 __________(填“高于”或“低于”)金刚石熔点。
已知其B—P键长均为x cm,则其密度为 ________g﹒cm—3(列出计算式即可)。
【答案】(1)1s22p63s23p3 (1分);3(1分)
(2)正四面体形(1分);60°(1分);大于(1分)
(3)电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的排斥力增大,键角变大。(3分)
(4)PCl4+(1分);sp3 (1分);PCl6-(1分)
(5)低于(1分);![]() 或
或 (3分)
(3分)
【解析】
试题分析:(1)基态磷原子中,共3个电子层,电子排布式为1s22s22p63s2s3p3,因此有3个未成对电子;
(2)磷的一种同素异形体——白磷(P4)的立体构型为正四面体形,其键角为 60。白磷是非极性分子,CS2也是非极性分子,水是极性分子,则根据相似相容原理可推测其在CS2中的溶解度大于在水中的溶解度。
(3)由于电负性N强于P,中心原子的电负性越大,成键电子对离中心原子越近,成键电子对之间距离越小,成键电子对之间的排斥力增大,因此键角变大。
(4)常温下PCl5是一种白色晶体,由A、B两种微粒构成。将其加热至148℃熔化,形成一种能导电的熔体,这说明形成的是分子晶体。已知A、B两种微粒分别与CCl4、SF6互为等电子体,由于原子数和价电子数分别都相等的是等电子体,则A为PCl4+,P原子的价层电子对数是4,且不存在孤对电子,因此其中心原子杂化轨道类型为sp3,B为PCl6-。
(5)磷化硼(BP)是一种超硬耐磨涂层材料,这说明形成的晶体是原子晶体。由于B和P原子半径均大于碳原子半径,所以其熔点低于金刚石熔点。根据均摊原则,每个晶胞含有4个P原子、4个B原子;已知其B—P键长均为x cm,则晶胞的体积为 ,因此磷化硼晶体的密度为
,因此磷化硼晶体的密度为 g﹒cm-3。
g﹒cm-3。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案