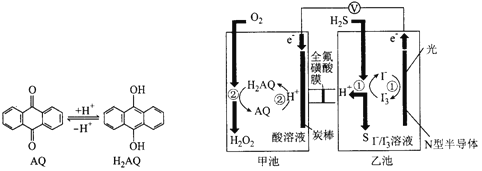
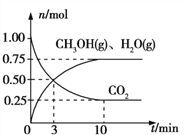
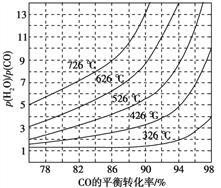
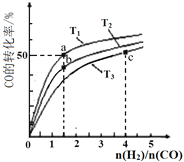
题目内容
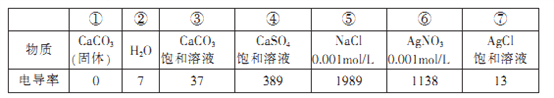
【题目】某研究性学习小组通过测量溶液的电导率(电导率越大,说明溶液的导电能力越强)探究沉淀溶解平衡,各物质的电导率数据如下:
下列分析不正确的是
A. CaCO3固体中不存在白由移动的离子
B. 与②对比,说明⑦中存在:AgCl=Ag++ Cl-
C. ⑤、⑥等体积混合后过滤,推测滤液的电导率一定大于13
D. 将①中固体加入④中,发生反应:![]()
【答案】D
【解析】A.碳酸钙为离子化合物,由离子构成,离子键形成离子键,离子不能自由移动,选项A正确;B.与②对比,导电率为13,说明⑦氯化银饱和溶液中存在:AgCl=Ag++Cl-,选项B正确;C.⑤、⑥等体积、等浓度混合,混合后过滤得到硝酸钠、硝酸银的饱和溶液,导电率大于1138,一定大于13,选项C正确;D.只有能满足c(SO42-)c(Ca2+)≥Ksp,才可能实现上述转化,选项D错误。答案选D。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某同学按下列步骤配制500mL 0.200mol·L-1 Na2CO3溶液,请回答有关问题。
实验步骤 | 有关问题 |
(1)计算所需Na2CO3的质量 | 需要Na2CO3的质量为_________g。 |
(2)称量Na2CO3固体 | 称量过程中主要用到的仪器是_____ |
(3)将Na2CO3加入100mL烧杯中 | 为加快溶解速率,可采取的措施是___ |
(4)将烧杯中的溶液转移至500mL容量瓶中 | 为防止溶液溅出,应采取的措施是____________________________________________________________________________ |
(5)向容量瓶中加蒸馏水至刻度线 | 在进行此操作时应注意的问题是______ |
(6)你认为按上述步骤配制的Na2CO3溶液的浓度是否为0.200mol·L-1,请说明理由。________
【题目】(题文)近年来,研究人员提出利用含硫物质热化学循环实现太阳能的转化与存储。过程如下:

(1)反应Ⅰ:2H2SO4(l)![]() 2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
2SO2(g)+2H2O(g)+O2(g) ΔH1=+551 kJ·mol-1
反应Ⅲ:S(s)+O2(g)![]() SO2(g) ΔH3=-297 kJ·mol-1
SO2(g) ΔH3=-297 kJ·mol-1
反应Ⅱ的热化学方程式:________________。
(2)对反应Ⅱ,在某一投料比时,两种压强下,H2SO4在平衡体系中物质的量分数随温度的变化关系如图所示。

p2_______p 1(填“>”或“<”),得出该结论的理由是________________。
(3)I-可以作为水溶液中SO2歧化反应的催化剂,可能的催化过程如下。将ii补充完整。
i.SO2+4I-+4H+![]() S↓+2I2+2H2O
S↓+2I2+2H2O
ii.I2+2H2O+_________![]() _________+_______+2 I-
_________+_______+2 I-
(4)探究i、ii反应速率与SO2歧化反应速率的关系,实验如下:分别将18 mL SO2饱和溶液加入到2 mL下列试剂中,密闭放置观察现象。(已知:I2易溶解在KI溶液中)
序号 | A | B | C | D |
试剂组成 | 0.4 mol·L-1 KI | a mol·L-1 KI 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 H2SO4 | 0.2 mol·L-1 KI 0.0002 mol I2 |
实验现象 | 溶液变黄,一段时间后出现浑浊 | 溶液变黄,出现浑浊较A快 | 无明显现象 | 溶液由棕褐色很快褪色,变成黄色,出现浑浊较A快 |
①B是A的对比实验,则a=__________。
②比较A、B、C,可得出的结论是______________________。
③实验表明,SO2的歧化反应速率D>A,结合i、ii反应速率解释原因:________________。