��Ŀ����
����Ŀ����Ҫ�����
��1������Fe��2HCl===FeCl2��H2�����ı��������������������������к�Ӱ�죿(����������������С������������)
�������¶ȣ�________��
���������������____________��
�ۼ���������NaCl��Һ��__________��
�ܵ��뼸��CuSO4��Һ��____________��
��2��һ���¶��£���ӦN2(g)��O2(g) ===2NO(g)���ܱ������н��У��ش����д�ʩ�Ի�ѧ��Ӧ���ʵ�Ӱ�졣(����������������С������������)
����С���ʹѹǿ����__________��
�ں��ݳ���N2��__________��
�ۺ�ѹ����He��__________��
��3���ں��º��������£����淴ӦA(g)��B(g) C(g)��D(g)���жϸ÷�Ӧ�Ƿ�ﵽƽ�������Ϊ__________(����ȷѡ��ǰ����ĸ)
a��ѹǿ����ʱ��ı�
b��������ܶȲ���ʱ��ı�
c��c(A)����ʱ��ı�
d����λʱ��������C��D�����ʵ������
��4��һ���¶��£���2 L���ܱ������У�X��Y��Z�������������ʱ��仯��������ͼ��ʾ��
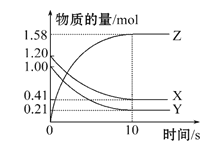
�ٴӷ�Ӧ��ʼ��10 sʱ����Z��ʾ�ķ�Ӧ����Ϊ________��X�����ʵ���Ũ�ȼ�����________��Y��ת����Ϊ________��
�ڸ÷�Ӧ�Ļ�ѧ����ʽΪ_________________________________________��
���𰸡����� ���� ��С ���� ���� ���� ��С c 0.079 mol��L��1��s��1 0.395 mol��L��1 79% ![]()
��������
��1���٣������¶ȣ���λ����ڷ�Ӧ���������Լ���Ч��ײƵ�����ӣ���ѧ��Ӧ��������
�ʴ�Ϊ������
�ڣ����������������λ����ڷ�Ӧ�����������䣬��Ч��ײƵ�ʲ��䣬��ѧ��Ӧ���ʲ��䣬
�ʴ�Ϊ�����䣻
�ۣ�NaCl���μӻ�ѧ��Ӧ������NaCl��Һ�൱�ڼ���ˮ����Һ������ӣ���λ����ڻ��������С����Ч��ײƵ�ʽ���С����ѧ��Ӧ���ʼ�С��
�ʴ�Ϊ����С��
�ܣ�����CuSO4��Һ����������Cu2+>H+����Cu2+����Fe�����û���Ӧ����Cu����Һ���γ���Fe-����-Cuԭ��أ����ӿ컯ѧ��Ӧ���ʣ�
�ʴ�Ϊ������
��2���٣�����ѹǿ����λ����ڻ���������ӣ���Ч��ײƵ�����ӣ���ѧ��Ӧ��������
�ʴ�Ϊ������
�ڣ�����N2��Ӧ��Ũ�����ӣ���λ����ڻ������������Ч��ײƵ�����ӣ���ѧ��Ӧ��������
�ʴ�Ϊ������
�ۣ���ѹ����He��He���μӻ�ѧ��Ӧ���������������λ����ڻ��������С����Ч��ײƵ�ʼ�С����ѧ��Ӧ���ʼ�С��
�ʴ�Ϊ����С��
��3���÷�Ӧ��������������Ӧ����Ӧ��ȫ��Ϊ���壻
a����Ӧ�ں��������н��У���������ʵ���֮�ȵ�����ѹǿ֮�ȣ��÷�ӦΪ����������Ӧ����Ӧ�����У����������ʵ������䣬ѹǿ���䣬�����жϷ�Ӧ�Ƿ���ƽ��״̬����a���������⣻
b����Ӧ�����У��������������䣬������������䣬���������ܶȲ��䣬�����жϷ�Ӧ�Ƿ���ƽ��״̬����b���������⣻
c����Ӧ�����У�A��Ũ�Ȳ������ñ䣬˵�����淴Ӧ������ȣ���˵����Ӧ�ﵽƽ��״̬����c�������⣻
d����C��D�Ļ�ѧ��������ȣ�����ڷ�Ӧ�����У���λʱ��������C��D�����ʵ���һ����ȣ������жϷ�Ӧ�Ƿ���ƽ��״̬����d���������⣻
�ʴ�Ϊ��c��
��4���٣��ӷ�Ӧ��ʼ��10sʱ��Z����������1.58mol�����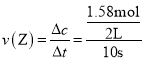 =0.079 mol��L��1��s��1����ͼ���֪��
=0.079 mol��L��1��s��1����ͼ���֪��![]() =0.395 mol��L��1��
=0.395 mol��L��1��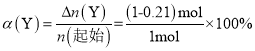 =79%��
=79%��
�ʴ�Ϊ��0.079 mol��L��1��s��1��0.395 mol��L��1��79%��
�ڣ���ͼ���֪����Ӧ�����У�Z�����ʵ��������ӣ�X��Y�����ʵ����ڼ��٣���ZΪ�����X��YΪ��Ӧ�10s�����ʵ����ʵ������ٷ����仯���ҷ�Ӧ���δ������ȫ���ʸ÷�ӦΪ���淴Ӧ��![]() ���ʸ÷�Ӧ�Ļ�ѧ����ʽΪ��
���ʸ÷�Ӧ�Ļ�ѧ����ʽΪ��![]()
�ʴ�Ϊ��![]() ��
��

 ��У����ϵ�д�
��У����ϵ�д�