题目内容
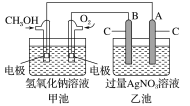
【题目】A~G各物质间的关系如下图,其中B、D为气态单质。
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
请回答下列问题:
(1)物质C和E的名称分别为________、________;
(2)可选用不同的A进行反应①,若能在常温下进行,其化学方程式为__________________________;
若只能在加热情况下进行,则反应物A应为________;
(3)写出D转化为G的化学方程式_____________________________________;
(4)新配制的F溶液应加入________以防止其转化为G。检验G溶液中阳离子的常用试剂是________,实验现象为________________________________________。
【答案】浓盐酸 四氧化三铁 2H2O2![]() 2H2O+O2↑ KClO3 2Fe + 3Cl2
2H2O+O2↑ KClO3 2Fe + 3Cl2![]() 2FeCl3 铁粉 KSCN溶液 溶液变为血红色
2FeCl3 铁粉 KSCN溶液 溶液变为血红色
【解析】
本题的突破点是MnO2,在中学化学中MnO2参与的反应主要是氧气和氯气的制备,所以依据框图的转化特点可知B是氧气,D是氯气,C是浓盐酸,E是四氧化三铁,F是氯化亚铁,G是氯化铁;Fe2+具有还原性,因此配制时需要加入铁粉防止被氧化;利用有关元素化合物知识,从质量守恒的角度书写化学方程式。
(1) 在中学化学中MnO2参与的反应主要是氧气和氯气的制备,所以依据框图的转化特点可知B是氧气,D是氯气,C是浓盐酸,E是四氧化三铁,F是氯化亚铁,G是氯化铁;
(2) MnO2参与制备氧气的反应有两种,一种是MnO2做催化剂的条件下,常温下H2O2分解制得氧气,其反应方程式为2H2O2![]() 2H2O+O2↑;另一种是由MnO2做催化剂的条件下,加热KClO3分解制得氧气,所以A为KClO3;
2H2O+O2↑;另一种是由MnO2做催化剂的条件下,加热KClO3分解制得氧气,所以A为KClO3;
(3)D为Cl2,G为FeCl3,Fe在氯气中燃烧生成FeCl3的化学方程式为2Fe + 3Cl2![]() 2FeCl3;
2FeCl3;
(4) Fe2+具有还原性,易被空气中的氧气所氧化,因此新配制的氯化亚铁溶液需要加入铁粉防止被氧化成Fe3+;检验FeCl3溶液中阳离子的常用试剂是KSCN溶液,实验现象为滴加KSCN溶液后,溶液变为血红色。

 应用题作业本系列答案
应用题作业本系列答案