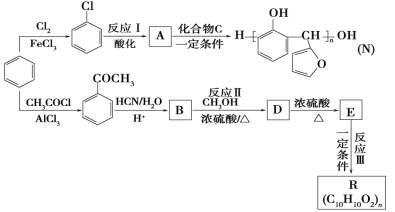
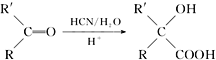题目内容
【题目】为探究NO与铜粉的反应,实验装置如图所示(夹持装置略)。实验开始前,向装置中通入一段时间的N2。
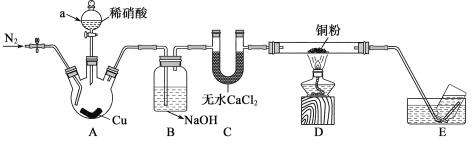
回答下列问题:
(1)通入N2的作用:_____________,仪器A的名称_____________。
(2)A中发生反应的离子方程式:_______________
(3)B中NaOH的作用__________________________。
(4)D中有__________________________现象,即可证明NO与Cu反应。
(5)NO可被Ce4+氧化,制得NH4NO3产品,流程如下(Ce为铈元素)。
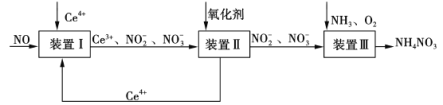
①装置Ⅰ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,写出生成等物质的量的NO3-和NO2-的离子方程式:________________。
②已知进入装置Ⅲ溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需通入标况下的O2________L(用含a代数式表示,结果保留整数)。
【答案】排除空气,防止NO被氧化 分液漏斗 3Cu+8H++2NO3-=3Cu2++NO↑+4H2O 吸收挥发的HNO3 红色粉末变为黑色 2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+ 243a
【解析】
铜和稀硝酸在装置A中反应生成NO,实验开始前向装置中通入一段时间的N2,排净装置内空气,由于硝酸具有挥发性,通过装置B中水吸收挥发出的硝酸,通过C中干燥剂干燥一氧化氮,NO通过装置D加热反应,铜和NO反应生成氮气和氧化铜,剩余气体在装置E中收集主要为氮气和一氧化氮,据此分析判断。
(5)根据题干信息,结合电子守恒、电荷守恒及原子守恒,可得反应的离子方程式,并根据反应中元素化合价变化数值与电子转移数值相等进行有关计算。
(1)通入N2的作用排除装置中排除空气,防止NO被氧化;根据仪器的结构可知仪器A的名称分液漏斗。
(2)A中Cu与稀硝酸发生反应,产生Cu(NO3)2、NO、H2O,发生反应的离子方程式为:3Cu+8H++2NO3-=3Cu2++NO↑+4H2O;
(3)硝酸具有挥发性,通过B中NaOH溶液吸收,所以B中NaOH的作用是吸收挥发的HNO3;
(4)D中发生反应:2NO+2Cu![]() 2CuO+N2;所以当看到D中有红色粉末变为黑色,即可证明NO与Cu反应。
2CuO+N2;所以当看到D中有红色粉末变为黑色,即可证明NO与Cu反应。
(5)①NO可被Ce4+氧化,制得NH4NO3产品,根据题干信息及电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式:2NO+3H2O+4Ce4+=NO3-+NO2-+6H++4Ce3+;
②NO2-的浓度为a g/L,要使1 m3该溶液中的NO2-完全转化为NH4NO3,n(NO2-)=(ag/L×1000L/m3)÷46g/mol=![]() mol,根据电子转移数目相等可得关系式2 n(NO2-)=4n(O2),n(O2)=
mol,根据电子转移数目相等可得关系式2 n(NO2-)=4n(O2),n(O2)=![]() n(NO2-)=
n(NO2-)=![]() mol,所以需通入标况下的O2的体积V(O2)=
mol,所以需通入标况下的O2的体积V(O2)=![]() mol ×22.4L/mol=243aL。
mol ×22.4L/mol=243aL。

 同步练习强化拓展系列答案
同步练习强化拓展系列答案【题目】合成氨工业中氢气可由天然气和水反应制备,其主要反应为:CH4(g)+2H2O(g)![]() CO2(g)+4H2(g)。
CO2(g)+4H2(g)。
已知下列键能数据:
化学键 | C—H | H—O | C=O | H—H |
键能/kJ·mol-1 | 414 | 464 | 803 | 436 |
则该反应的△H=( )
A.+162kJ·mol-1B.-766kJ·mol-1C.-162kJ·mol-1D.+1470kJ·mol-1
【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
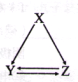
选项 | X | Y | Z |
A | AlCl3 | Al(OH)3 | NaAlO2 |
B | C | CO | CO2 |
C | CH2=CH2 | CH3CH2Br | CH3CH2OH |
D | S | SO2 | SO3 |
A.AB.BC..CD.D