题目内容
15.设NA表示阿伏伽德罗常数的值,下列说法错误的是( )| A. | 标准状况下80gSO2与33.6LCO2含氧原子数目均为3NA | |
| B. | 2molNO与1molO2混合后气体分子数小于2NA | |
| C. | 电解精炼铜时,阳极上粗铜质量减少6.4g,则电路中转化电子数为0.2NA | |
| D. | 1molCnH2n(烯烃)含有的共用电子对数为3nNA |
分析 A、分别求出二氧化硫和二氧化碳的物质的量,然后根据1mol二氧化硫和1mol二氧化碳中均含2mol氧原子来分析;
B、NO2气体中存在平衡:2NO2?N2O4;
C、电解精炼铜时,阳极上放电的不只铜,还有比铜活泼的金属杂质;
D、1molCnH2n(烯烃)中含有2nmolC-H键、(n-2)molC-C键和1mol碳碳双键.
解答 解:A、1mol二氧化硫和1mol二氧化碳中均含2mol氧原子,80g二氧化硫的物质的量n=$\frac{80g}{64g/mol}$=1.25mol,含有2.5mol氧原子,个数为2.5NA个;标况下,33.6L二氧化碳的物质的量n=$\frac{33.6L}{22.4L/mol}$=1.5mol,含有的氧原子的物质的量为3mol,即3NA个,故A错误;
B、2molNO与1molO2混合后发生反应:2NO+O2=NO2,生成的NO2的物质的量为2mol,而NO2气体中存在平衡:2NO2?N2O4,导致气体的分子数变少,故所得气体中的分子数目小于2NA个,故B正确;
C、电解精炼铜时,活泼金属优先在阳极上失去电子,粗铜中铁、锌等杂质摩尔质量小于铜的,6.4g金属失去的电子大于0.2mol,转移的电子数目大于0.2 NA,故C错误;
D、1molCnH2n(烯烃)中含有2nmolC-H键、(n-2)molC-C键和1mol碳碳双键,故共含有3nmol共用电子对,即3nNA个,故D正确.
故选AC.
点评 本题考查了物质的量以及阿伏伽德罗常数的有关计算,熟练掌握公式的使用以及物质的结构特点是解题关键,难度不大.

练习册系列答案
相关题目
11.100mL 6mol•L-1H2SO4跟过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量( )
| A. | 碳酸钠(固体) | B. | 少量硫酸铜溶液 | C. | NaCl溶液 | D. | 加热 |
12.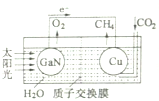 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
 科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )
科学家用氮化镓材料与铜组装成如图的人工光合系统,实现了以CO2和H2O为原料合成CH4,下列有关说法中正确的是( )| A. | 该装置是将化学能转化为电能 | |
| B. | 氮化镓电极是正极 | |
| C. | 铜电极表面的电极反应式为:CO2+8e-+8H+=CH4+2H2O | |
| D. | 可用盐酸作该装置的电解液 |
3.25℃时,向10ml0.01mol/LKOH溶液中滴加0.01mol/L苯酚溶液,混合溶液中粒子浓度关系正确的( )
| A. | pH>7时,c(C6H5O-)>c(K+)>c(H+)>c(OH-) | |
| B. | pH<7时,c(K+)>c(C6H5O-)>c(H+)>c(OH-) | |
| C. | V[C6H5OH(aq)]=20ml时,c(C6H5O-)+c(C6H5OH)=2c(K+) | |
| D. | V[C6H5OH(aq)]=10ml时,c(K+)=c(C6H5O-)>c(OH-)=c(H+) |
10.NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 常温常压下,21g氧气和27g臭氧所含氧原子总数为3NA | |
| B. | 34gH2O2中含阴离子数为NA | |
| C. | 饱和FeCl3溶液加入沸水中,若有1molFeCl3水解,可生成NA个胶体粒子 | |
| D. | 80mL10mol/L浓盐酸与足量MnO2加热反应,转移电子数为0.4NA |
20.下列有关元素递变情况的说法正确的是( )
| A. | Na、Al、Mg的还原性依次增强 | B. | Na、K、Rb的金属性依次减弱 | ||
| C. | Al、Si、P的原子半径依次增大 | D. | B、C、N的最高正化合价依次升高 |
4.关于元素周期表,下列叙述中不正确的是( )
| A. | 在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 | |
| B. | 在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 | |
| C. | 在金属元素区域可以寻找制备新型农药材料的元素 | |
| D. | 过渡元素是副族和第Ⅷ族元素的总称 |
5.根据如表推断下列说法中不正确的是( )
| 性质 | 金刚石 | 石墨 |
| 外观 | 无色,透明固体 | 灰黑,不透明固体 |
| 沸点 | ? | ? |
| 熔点 | ? | ? |
| 燃烧热/kJ•mol-1 | 395.4 | 393.5 |
| A. | C(石墨,s)═C(金刚石,s)△H=+1.9kJ•mol-1 | |
| B. | 在相同条件下石墨的熔点应高于金刚石 | |
| C. | 金刚石中碳碳键键能大于石墨中碳碳键键能 | |
| D. | 在相同条件下石墨和金刚石的沸点应相同 |